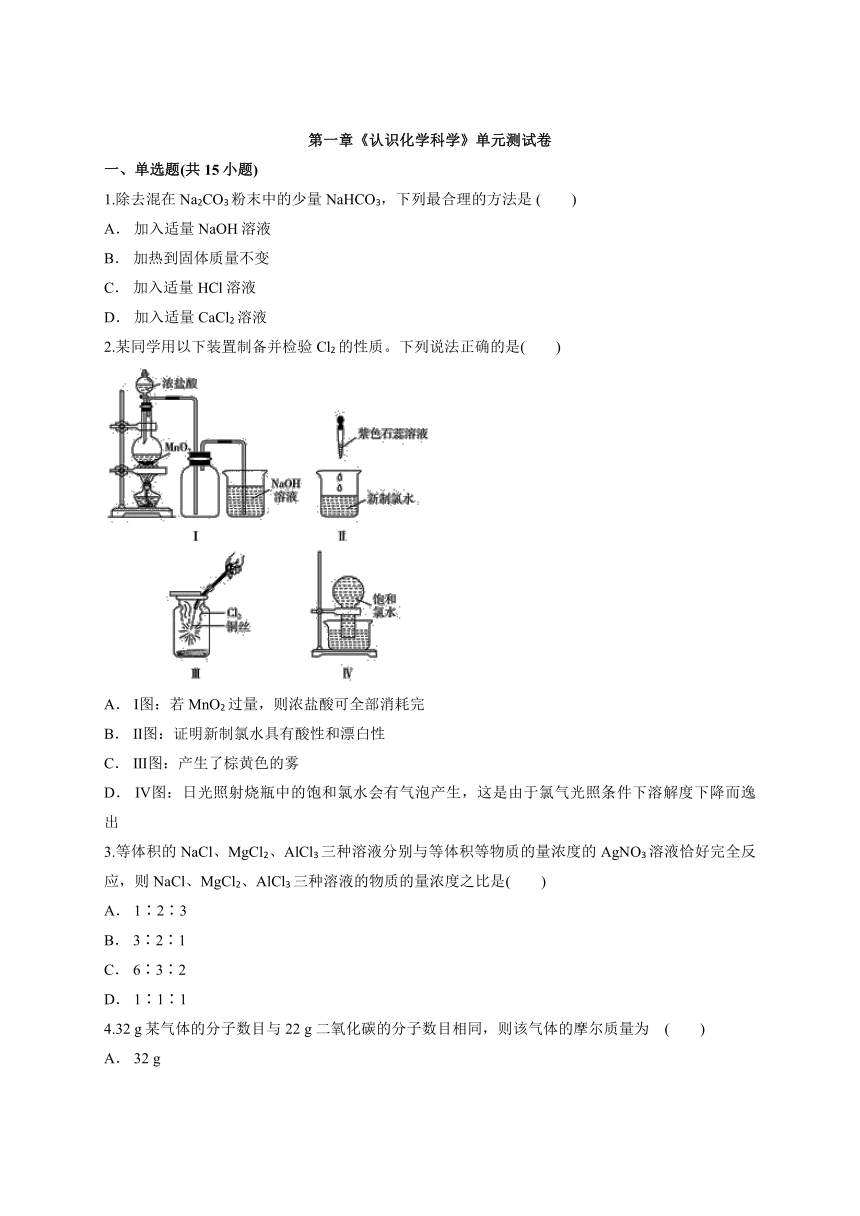
第一章《认识化学科学》单元测试卷 一、单选题(共15小题) 1.除去混在Na2CO3粉末中的少量NaHCO3,下列最合理的方法是 ( ) A. 加入适量NaOH溶液 B. 加热到固体质量不变 C. 加入适量HCl溶液 D. 加入适量CaCl2溶液 2.某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( ) A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完 B. Ⅱ图:证明新制氯水具有酸性和漂白性 C. Ⅲ图:产生了棕黄色的雾 D. Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气光照条件下溶解度下降而逸出 3.等体积的NaCl、MgCl2、AlCl3三种溶液分别与等体积等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、MgCl2、AlCl3三种溶液的物质的量浓度之比是( ) A. 1∶2∶3 B. 3∶2∶1 C. 6∶3∶2 D. 1∶1∶1 4.32 g某气体的分子数目与22 g 二氧化碳的分子数目相同,则该气体的摩尔质量为 ( ) A. 32 g B. 32 g·mol-1 C. 64 g·mol-1 D. 64 g 5.在实验室制取Cl2时,尾气一般要用NaOH溶液吸收而不用澄清石灰水吸收的理由是( ) A. 氯气不与石灰水反应 B. Ca(OH)2微溶于水,澄清石灰水中Ca(OH)2的含量少,吸收的尾气也很少 C. 氯气与Ca(OH)2反应生成的CaCl2难溶于水 D. 澄清石灰水能吸收空气中的CO2而变浑浊 6.把5%的碳酸钠溶液蒸发掉64.3 g水后,溶液变为31 mL,浓度变为14%,没有晶体析出,则浓缩后碳酸钠溶液的物质的量浓度为( ) A. 8.52 mol·L-1 B. 4.26 mol·L-1 C. 1.52 mol·L-1 D. 3.04 mol·L-1 7.某同学查阅资料得知:氯、溴等统称为卤族元素,在性质上具有相似性,那么在探究溴单质的性质时,其基本程序应该是 ( ) A. 做实验并观察实验现象→分析、解释,得出结论 B. 观察溴的外观性质→做实验并观察实验现象→分析、解释,得出结论 C. 观察溴的外观性质→预测溴的化学性质→做实验并观察实验现象→分析、解释,得出结论 D. 预测溴的性质→做实验并观察实验现象→分析、解释,得出结论→观察溴的外观性质 8.下列物质在一定条件下均能产生氧气,其中最适合用于宇航员(宇航员呼吸所需的氧气主要来自太空服中的呼吸面具)出舱时的供氧剂的是( ) A. H2O2 B. KMnO4 C. KClO3 D. Na2O2 9.将4 g氢氧化钠溶解在10 mL水中,再稀释成1 L,从中取出10 mL,这10 mL溶液的物质的量浓度是( ) A. 1 mol·L-1 B. 0.1 mol·L-1 C. 0.01 mol·L-1 D. 10 mol·L-1 10.设NA为阿伏加德罗常数的值,下列说法中正确的是( ) A. 0.2 mol氧原子中含1.6NA个电子 B. 1 mol 氯化镁中含有离子数为NA C. 12.4 g白磷中含有磷原子数为0.1NA D. 28 g一氧化碳气体所含的电子数为20NA 11.下列关于“容量瓶及其使用”的叙述中不正确是( ) A. 容量瓶是配制一定物质的量浓度溶液的专用仪器 B. 常见的规格有100 mL、250 mL、380 mL、500 mL及1 000 mL C. 选用的容量瓶的容积应等于或略大于所配溶液的体积 D. 使用前要检验容量瓶是否漏水 12.1 mol·L-1硫酸溶液的含义是( ) A. 1 L水中含有1 mol硫酸 B. 1 L溶液中含1 mol H+ C. 将98 g硫酸溶于1 L水所配成的溶液 D. 从1 L溶液中取出500 mL后,剩余溶液的浓度仍为1 mol·L-1 13.对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( ) A. 答案A B. 答案B C. 答案C D. 答案D 14.已知Fe(OH)3为红褐色,下列关于钠的反应现象的叙述中,不正确的是( ) A. 答案A B. 答案B C. 答案C D. 答案D 15.下列说法中正确的是 ( ) ①钠在空气中燃烧生成白色的氧化钠 ②钠与硫酸铜溶液反应,可置换出铜 ③过氧化钠与水反应时可放出氧气 ④氯气与铁反应生成三氯化铁 ⑤钠、氢气都能在氯气中燃烧生成白雾 ⑥久置的氯水,因氯气几乎完全挥发掉 ... ...
~~ 您好,已阅读到文档的结尾了 ~~