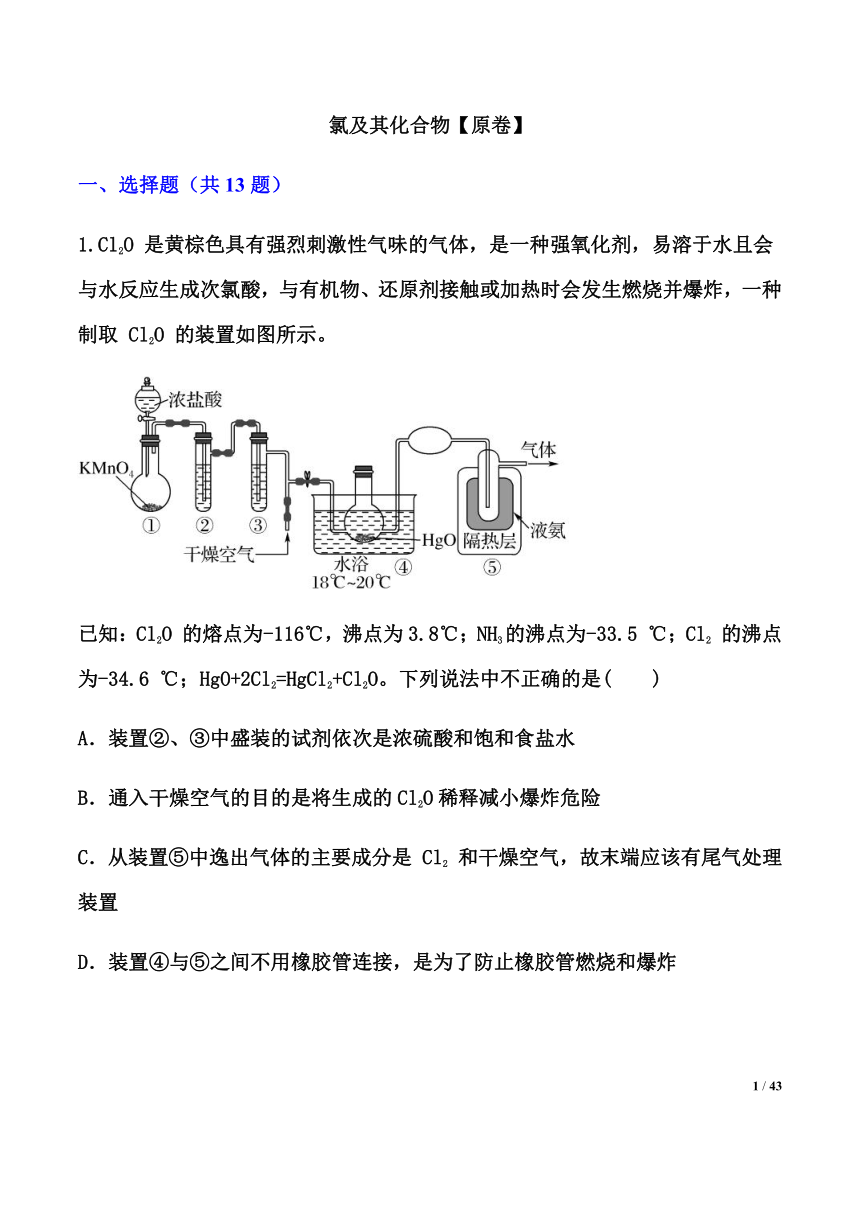
氯及其化合物【原卷】 一、选择题(共13题) 1.Cl2O 是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸,一种制取 Cl2O 的装置如图所示。 已知:Cl2O 的熔点为-116℃,沸点为3.8℃;NH3的沸点为-33.5 ℃;Cl2 的沸点为-34.6 ℃;HgO+2Cl2=HgCl2+Cl2O。下列说法中不正确的是( ) A.装置②、③中盛装的试剂依次是浓硫酸和饱和食盐水 B.通入干燥空气的目的是将生成的Cl2O稀释减小爆炸危险 C.从装置⑤中逸出气体的主要成分是 Cl2 和干燥空气,故末端应该有尾气处理装置 D.装置④与⑤之间不用橡胶管连接,是为了防止橡胶管燃烧和爆炸 2.某温度下将氯气通入过量 KOH 溶液中,反应后得到 KCl、KClO 和 KClO3的混合溶液。下列说法中,不正确的是( ) A.反应消耗的Cl2与生成的 H2O 的物质的量之比始终为 1∶1,与产物组成无关 B.若n(ClO-)∶n (ClO)=1∶1,则反应消耗的氯气与转移电子数的物质的量之比为 2∶3 C.若n(ClO-)∶n(ClO)=11∶1,则反应中被还原与被氧化的氯元素的物质的量之比为 4∶3 D.反应消耗的Cl2与 KOH 的物质的量之比取决于反应产物的组成 3.氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。氯气-氯水体系中存在以下平衡关系: Cl2(g) Cl2(aq) ① Cl2(aq)+ H2OHClO + HCl ② 下列表述正确的是( ) A.反应②的平衡常数K= B.氯水中加入硫酸调节pH, pH越低消毒能力越强 C.氯处理饮用水时,在夏季的杀菌效果比在冬季好 D.氯水中加入四氯化碳进行萃取,反应②逆向移动,反应①正向移动 4.Cl2O是黄棕色的气体,强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。一种制取Cl2O的装置如图所示: 已知:①HgO+2Cl2=HgCl2+Cl2O;②Cl2O沸点为3.8℃;Cl2的沸点为-34.6℃。下列说法中正确的是( ) A.Cl2O与水的反应中,生成的次氯酸是氧化产物 B.装置②③中的药品依次为浓硫酸、饱和食盐水 C.装置④中固体增重1.1 g,可制得0.02 mol Cl2O D.干燥空气的作用是稀释Cl2O,可用甲烷代替 5.如图在A处通入 Cl2,当关闭B阀时,C处湿润的红色布条没有明显变化,当打开B阀时,C处湿润的红色布条逐渐褪色,则D瓶中所装的液体是( ) A.水 B.浓硫酸 C.NaOH溶液 D.NaCl溶液 6.为探究新制氯水的性质,某学生做了如下实验。其中涉及离子反应方程式书写正确的是 实验 装置 试剂X 现象 ① 滴有酚酞的NaOH溶液 溶液红色褪色 ② NaHCO3溶液 产生气泡 ③ HNO3酸化的AgNO3溶液 产生白色沉淀 ④ FeCl2溶液、KSCN溶液 溶液变红 A.实验①:Cl2+2NaOH=Cl-+ClO-+2Na++H2O B.实验②:+HClO=ClO-+CO2↑+H2O C.实验③:ClO-+Ag++H2O=AgCl↓+2OH- D.实验④:Cl2+2Fe2+=2Fe3++2Cl- 7.与久置氯水相比,新制氯水 A.酸性强 B.氧化性强 C.颜色浅 D.微粒种类少 8.根据有关实验现象推理得出新制氯水中一定存在某物质的结论正确的是( ) A.氯水呈浅黄绿色,且有刺激性气味,说明氯水中有 B.将红色布条浸没在氯水中,布条褪色,说明氯水中有 C.向氯水中滴硫酸酸化的溶液产生白色沉淀,说明氯水中有 D.向滴有酚酞的溶液中滴加氯水,溶液红色变浅,说明氯水中有盐酸 9.为探究新制氯水的性质,某学生做了如图实验。 实验 装置 试剂a 现象 ① 紫色的石蕊试液 溶液先变红后褪色 ② NaHCO3溶液 产生气泡 ③ HNO3酸化的AgNO3溶液 产生白色沉淀 ④ FeCl2溶液、KSCN溶液 溶液变红 由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是( ) A.实验①说明新制氯水中含有H+、HClO B.实验②发生的反应为:HCO+HClO=ClO-+CO2↑+H2O C.实验③说明新制氯水中存在Cl-,发生的反应为:Cl-+Ag+=AgCl↓ D. ... ...
~~ 您好,已阅读到文档的结尾了 ~~