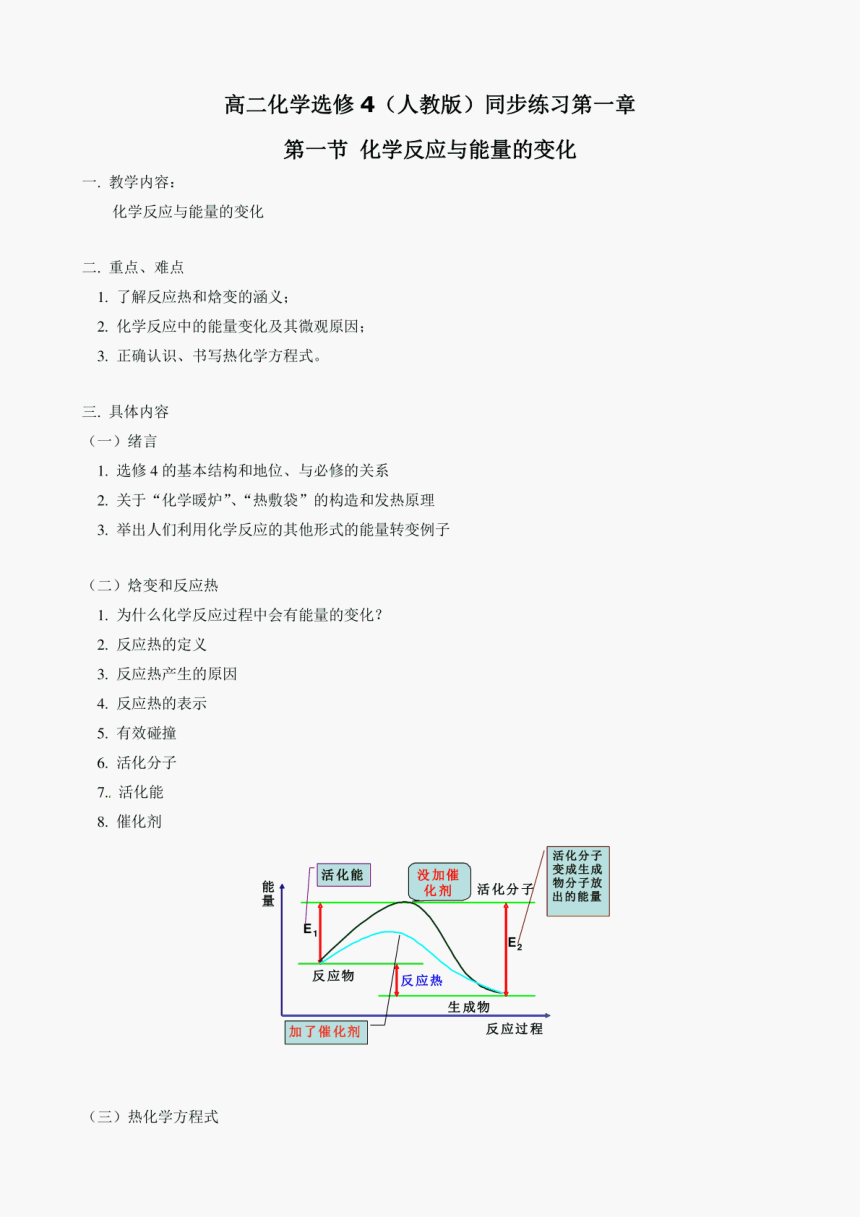
高二化学选修4(人教版)同步练习第一章 第一节化学反应与能量的变化 教学内容: 化学反应与能量的变化 二.重点、难点 1.了解反应热和焓变的涵义; 2.化学反应中的能量变化及其微观原因; 3.正确认识、书写热化学方程式。 三.具体内容 (一)绪言 1.选修4的基本结构和地位、与必修的关系 2.关于“化学暖炉”、“热敷袋”的构造和发热原理 3.举出人们利用化学反应的其他形式的能量转变例子 (二)焓变和反应热 1.为什么化学反应过程中会有能量的变化? 2.反应热的定义 3.反应热产生的原因 4.反应热的表示 5.有效碰撞 6.活化分子 7.活化能 8.催化剂 活化分子 活化能 没加催 变成生成 能 量 化剂丿活化分子物分子放 出的能量 反应物 反应热 生成物 加了催化剂 反应过程 (三)热化学方程式 1.定义 2.表示意义 3.与普通化学方程式的区别 4.热化学方程式的书写应注意的问题 (四)实验:中和反应、反应热的测定 【典型例题】 例1J已知在25℃、101kPa下, Ig Cgh1s(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ的热量。表 示上述反应的热化学方程式正确的是() A.CsH18(1)+25/2O2(g)=8CO2(g)+9H2O(g)△H=-4840kJ·mol B.CH18(1)+25/202(g)=8CO2(g)+9H2O(l)△H=5518kJ·mol C.CsH18(1)+25/202(g)=8CO2(g)+9H2O△H=+5518kJ·mo1 D.CH18(1)+25/2O2(g)=8CO2(g)+9H2O(1)△H=4840kJ·mol 答案:B 解析:掌握书写热化学方程式的基本注意事项。 例2]0.3mol的气态高能燃料乙硼烷(BH6)在O2中燃烧,生成固态B2O3和液态水,放出649.5kJ的热量, 其热化学方程式为 又知:H2O(1)=H2O(g)△H=+44kJ·mol,则11.2L(标准状况下)B2H6完全燃烧生成气态水 时放出的热量是kJ。 答案:B2H(g)+3O2(g)=B2O3(s)+3H2O(1)△H=2165kJ·mol;1016.5。 解析:考察反应热的计算和两个热量变化过程的分析。 [例3]已知胆矾溶于水时溶液温度降低,室温下将lmol无水硫酸铜制成溶液时放出的热量为Q。又知胆 矾分解的热化学方程式为:CusO4·5HO(s)=CuSO4(s)+5H2O(1) △H=+Q2kJ·mol,则Q1和Q2的关系为() A QI
~~ 您好,已阅读到文档的结尾了 ~~