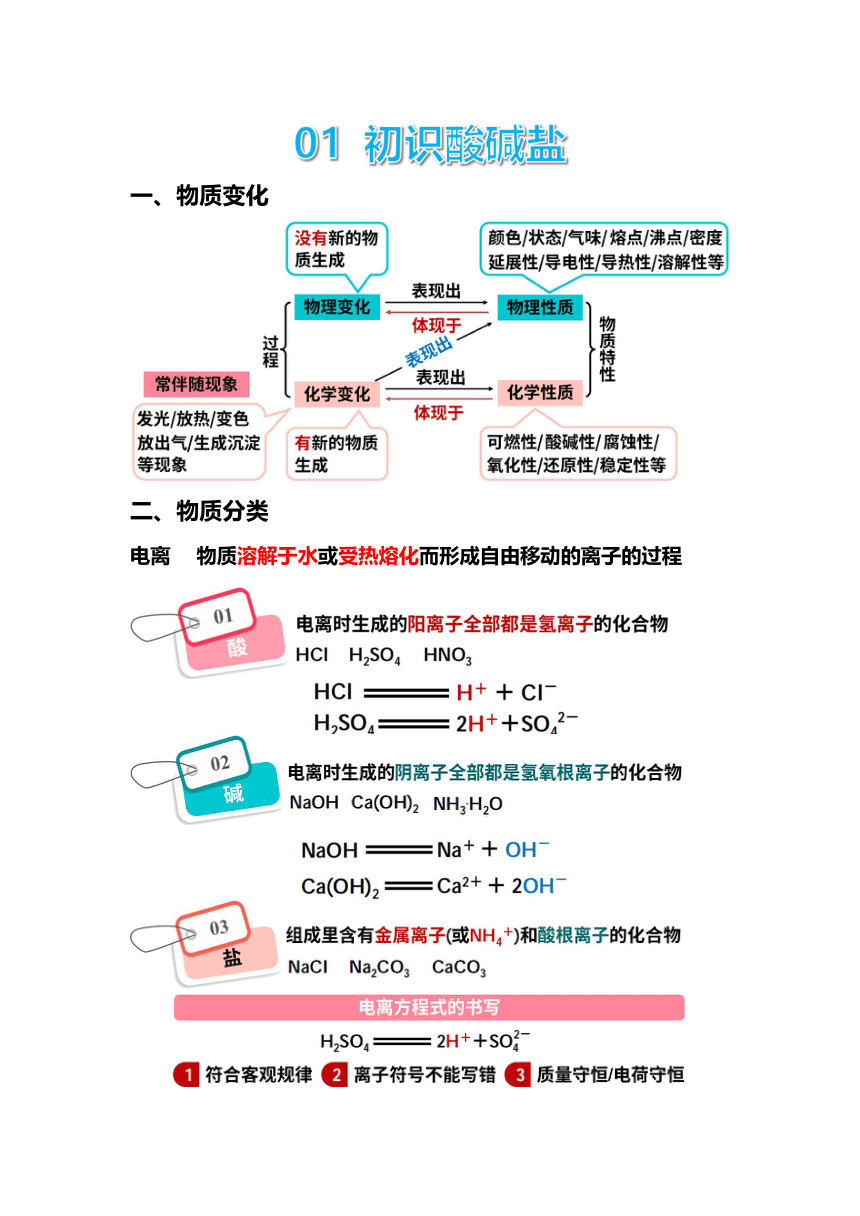
一、物质变化 二、物质分类 电离 物质溶解于水或受热熔化而形成自由移动的离子的过程 三、酸碱指示剂 指示剂 酸性溶液 (pH<7) 碱性溶液 (pH>7) 中性溶液 (pH=7) 紫色石蕊试液 红色 蓝色 紫色 无色酚酞试液 无色 红色 无色 特别提醒: 酸碱指示剂与酸性或碱性溶液发生颜色改变是化学变化,而且变色的是酸碱指示剂,而不是酸碱性溶液。 四、溶液酸碱度 知识点一 溶液酸碱度的表示方法 1.溶液的酸碱度:用来定量表示溶液的酸碱性强弱程度。溶液的酸碱度常用pH来表示,其范围为0~14。 2.pH与溶液酸碱性的关系如图所示。 pH<7时,溶液呈酸性, pH越小,酸性越强; pH=7时,溶液呈中性; pH>7时,溶液呈碱性, pH越大,碱性越强。 知识点二 pH的测定方法 测定溶液的pH最简单的方法是用pH试纸,操作步骤是:用洁净、干燥的玻璃棒蘸取少量待测液滴在pH试纸上,将试纸显示的颜色与标准比色卡对照,看与哪种颜色最接近,从而确定被测溶液的pH,读数为整数。 特别提醒 ① pH试纸不能用蒸馏水润湿,否则可能使测量结果不准确。若待测溶液是酸性溶液,结果比实际值偏大;若待测溶液是碱性溶液,结果比实际值偏小。 ② pH试纸不能直接放入待测溶液内,以免将待测溶液全部污染。 ③ 用pH试纸测溶液的pH比较粗略,结果为整数。 知识点三 了解溶液酸碱度的意义 1.农作物一般适宜在pH=7或接近7的土壤中生长。 2.我们将pH<5.6的降雨称为酸雨。测定雨水的pH能了解空气的污染程度 pH变化曲线的理解及应用 酸和碱的中和反应 ① 酸加入碱中 ② 碱加入酸中 ① 酸入碱:在O点时,溶液的pH>7, 此时溶液显碱性,随着酸的加入,pH不断减小,当酸碱恰好中和时,溶液的pH=7,继续加酸,溶液的pH<7,溶液呈酸性 ② 碱入酸:跟“酸入碱”时情况相反 酸、碱的稀释 ① 酸加入水中 ② 碱加入水中 ① 酸中加水:开始时溶液的pH<7,随着水量的增加,pH不断增大,无限接近7,但不会等于或大于7 ② 碱中加水:开始时溶液的pH>7,随着水量的增加,pH不断减小,无限接近7,但不会等于或小于7 02 常见的酸 一、三大强酸 盐酸(HCl的水溶液) 混合物 物理性质 ① 纯净的盐酸是无色透明的液体 ② 有刺激性气味,浓盐酸易挥发 问:浓盐酸瓶口白雾是什么? 答:挥发出来的氯化氢气体与空气中的水蒸气形成的盐酸小液滴 化学性质 往AgNO3溶液中滴加盐酸,有白色沉淀生成 HCl + AgNO3 ═ AgCl ↓+ HNO3 (AgCl是不溶于水也不溶于酸的白色沉淀) 重要结论:AgNO3溶液可用于检验盐酸或CI-的存在 硫酸(H2SO4) 物理性质 ① 纯硫酸是无色粘稠的油状液体 ② 不易挥发 ③ 密度比水大 ④ 浓硫酸具有吸水性,常作干燥剂(如图) 拓展延伸 浓盐酸敞口放置一段时间后,溶质的质量减小,溶剂的质量不变,溶质质量分数减小;浓硫酸敞口放置一段时间后,溶质的质量不变,溶剂的质量增大,溶质质量分数减小;所以浓硫酸、浓盐酸都要密封保存。 ⑤ 浓硫酸溶于水放出大量的热,所以稀释浓硫酸的操作是把浓硫酸沿容器壁慢慢注入水中,并用玻璃棒不断搅拌。 特别提醒 稀释浓硫酸时,不能将水倒入浓硫酸中!如果将水注入浓硫酸,由于水的密度较小,浮在浓硫酸上面,溶解时放出的热能使水立即沸腾,使硫酸液滴四处飞溅,非常危险。应将浓硫酸缓慢倒入水中,并不断搅拌,即“酸入水,沿器壁,缓慢倒,不断搅”。 化学性质 ① 浓硫酸具有很强的腐蚀性(脱水性) 实验内容 放置一会后的实验现象 用玻璃棒蘸浓硫酸在纸上写字 纸上出现黑色字迹 用小木棍蘸少量浓硫酸 粘有浓硫酸的部位变黑 将浓硫酸滴到一小块布上 滴有硫酸的部位被腐蚀 特别提醒 使用浓硫酸时,如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。 ② 硫酸根的特性 往Ba(NO3)2溶液中滴 ... ...
~~ 您好,已阅读到文档的结尾了 ~~