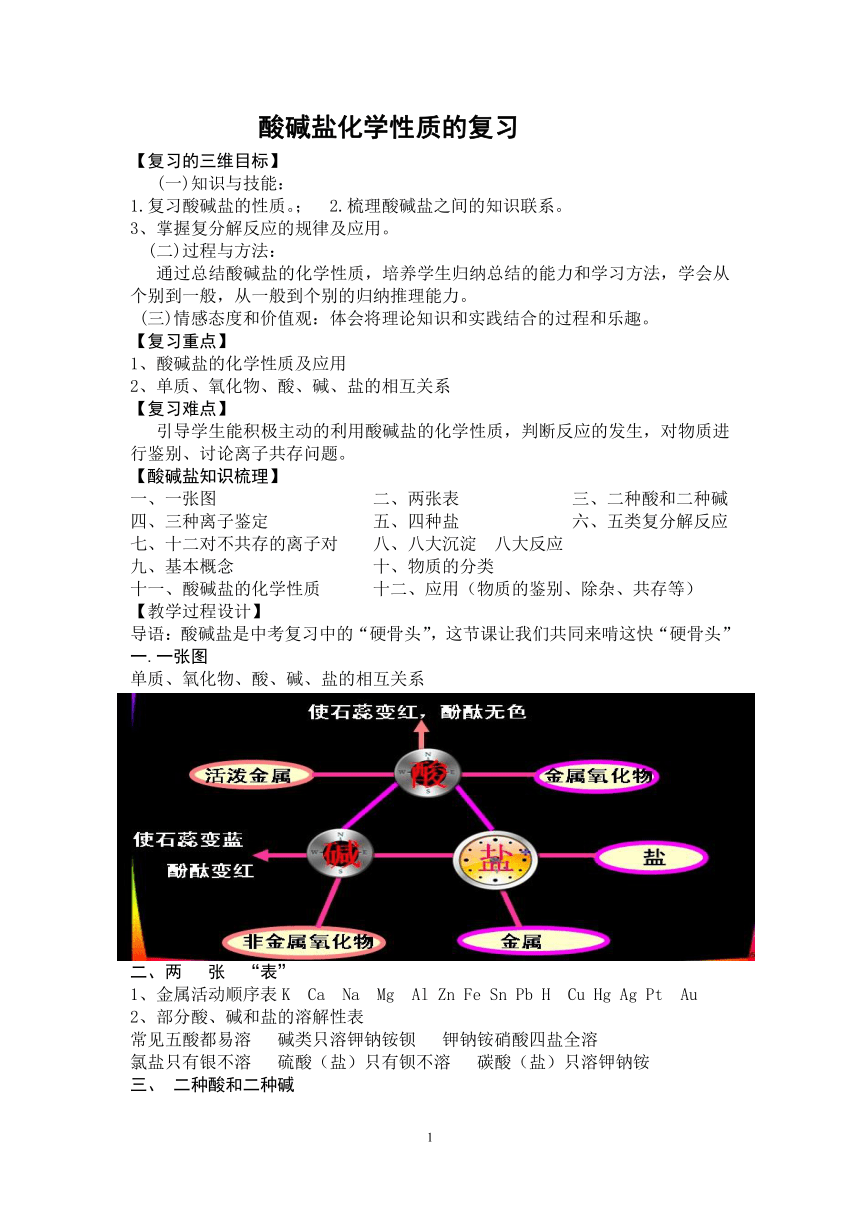
酸碱盐化学性质的复习 【复习的三维目标】 (一)知识与技能: 1.复习酸碱盐的性质。; 2.梳理酸碱盐之间的知识联系。 3、掌握复分解反应的规律及应用。 (二)过程与方法: 通过总结酸碱盐的化学性质,培养学生归纳总结的能力和学习方法,学会从个别到一般,从一般到个别的归纳推理能力。 (三)情感态度和价值观:体会将理论知识和实践结合的过程和乐趣。 【复习重点】 1、酸碱盐的化学性质及应用 2、单质、氧化物、酸、碱、盐的相互关系 【复习难点】 引导学生能积极主动的利用酸碱盐的化学性质,判断反应的发生,对物质进行鉴别、讨论离子共存问题。 【酸碱盐知识梳理】 一、一张图 二、两张表 三、二种酸和二种碱 四、三种离子鉴定 五、四种盐 六、五类复分解反应 七、十二对不共存的离子对 八、八大沉淀 八大反应 九、基本概念 十、物质的分类 十一、酸碱盐的化学性质 十二、应用(物质的鉴别、除杂、共存等) 【教学过程设计】 导语:酸碱盐是中考复习中的“硬骨头”,这节课让我们共同来啃这快“硬骨头” 一.一张图 单质、氧化物、酸、碱、盐的相互关系 二、两 张 “表” 1、金属活动顺序表K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au 2、部分酸、碱和盐的溶解性表 常见五酸都易溶 碱类只溶钾钠铵钡 钾钠铵硝酸四盐全溶 氯盐只有银不溶 硫酸(盐)只有钡不溶 碳酸(盐)只溶钾钠铵 三、 二种酸和二种碱 二种酸:HCl、 H2SO4二种碱NaOH、Ca(OH)2 四、三种离子鉴定 1、 H+:紫色石蕊试液等2、 OH-:无色酚酞试液等 3、 CO32-:稀盐酸和澄清石灰水 五、四种盐(NaCl、Na2CO3、NaHCO3、CaCO3) “氢头酸尾是酸” 、“金头碱尾是碱” 、 “金头酸尾是盐” 六、 五类复分解反应 金属氧化物+酸、 酸+碱、酸+盐、碱+盐、盐+盐 七、12对不能共存的离子对 八、八大沉淀 八大反应 (一)八大沉淀AgCl BaSO4 BaCO3 CaCO3 Ag2CO3 Mg(OH) 2 Fe(OH)3 Cu(OH) 2 (二)八大反应 a、(1)酸+金属(2)盐+金属 (置换反应) b、(1)酸+碱 (2)酸+金属氧化物 (3)酸+盐(4)碱+盐 (5)盐+盐 (复分解反应) c、碱+非金属氧化物 (什么基本反应类型都不是) 九、基本概念: 置换反应 、中和反应、复分解反应 (一)置换反应 : 1、金属A+盐BC →盐AC+金属B 发生条件:前换后,盐可溶 注意:(1)不要用K、Ca、Na置换盐溶液中的金属 (2)铁参加的置换反应生成的都是亚铁盐 2、酸 + 金属 → 盐 + 氢气 发生条件:金属>H 3、氢气、碳还原氧化铜 (二)中和反应:酸与碱生成盐和水的反应。 (三) 复分解反应 【基本反应类型】 发生条件:在溶液中的反应,生成物中是否有沉淀或水或气体生成,碱与盐、盐与盐反应要求反应物均可溶 AB + CD==AD + CB特点:双交换,价不变。 十、酸碱盐的化学性质及应用 (一)酸的化学性质 1、酸与指示剂作用:使紫色石蕊试液变红,使无色酚酞试液不变色 2、酸+活泼金属→盐+H2 3、酸+金属氧化物→盐+水 4、酸+碱→盐+水 5、酸+(某些)盐→新酸+新盐 (二)碱的的化学性质 1、碱溶液与指示剂作用:使紫色石蕊试液变蓝使无色酚酞试液变红 2、碱+盐→新盐+新碱 注意:(1)反应物都可溶 (2)生成物须有一沉淀 3、碱+酸→盐+水 注意:(1)反应物都可溶 (2)生成物须有一沉淀 4、碱+非金属氧化物→盐+水 (三)盐的的化学性质 1、盐+金属→新金属+金属 (1)发生条件:前换后,盐可溶 (2)不用钾、钙、钠反应 2、盐+酸→新酸+新盐3、盐+碱→新碱+新盐 4、盐+盐→两种新盐 (设疑) 1.上面的化学性质中哪些类型属于复分解反应 2.分析上述酸碱盐之间的反应,它们的生成物有什么特点? 3.酸、碱、盐之间是否一定会发生复分解反应? 例:下列反应是否能进行? ① Fe+CuSO4——— ② HCl+Fe——— ③ Na2CO3+CaCl2——— ... ...
~~ 您好,已阅读到文档的结尾了 ~~