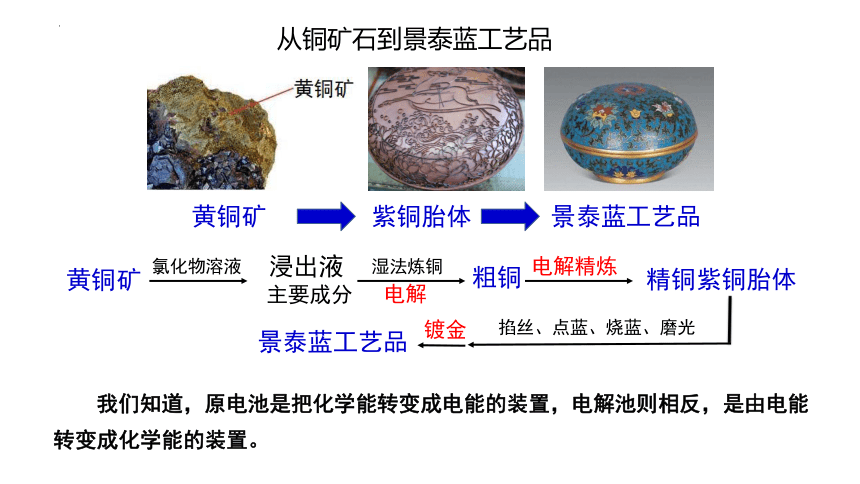
(
课件网) 从铜矿石到景泰蓝工艺品 黄铜矿 紫铜胎体 景泰蓝工艺品 黄铜矿 氯化物溶液 浸出液 主要成分 湿法炼铜 粗铜 电解 电解精炼 精铜紫铜胎体 掐丝、点蓝、烧蓝、磨光 镀金 景泰蓝工艺品 我们知道,原电池是把化学能转变成电能的装置,电解池则相反,是由电能转变成化学能的装置。 组织建设 第三节 电解池 (第1课时 电解原理) 第四章 电化学基础 【实验4-1】在U形管中注入CuCl2溶液,插入两根石墨棒作电极(如图4-8),把 湿润的碘化钾淀粉试纸放在与直流电源正极相连的石墨棒(阳极)附近。接通直流 电源,观察U形管内的现象和试纸颜色的变化。 确定微粒种类及移动方向 根据放电顺序确定放电微粒 写出电极反应式和总反应 溶质:CuSO4 = Cu2++SO42- 溶剂:H2O H++OH- 阳 极 H+ 阴极 Cu2+ SO42- √ OH- √ 放电顺序: Cu2+> H+ OH-> SO42- 有气泡,湿润KI-淀 粉试纸变蓝,气体有刺激性气味 碳棒上有一层红色的物质析出 阴极: 阳极: 阳离子 阴极 阴离子 阳极 闭合回路特点 e- 溶液中离子定向移动 负极 阴极 阳极 正极 e- 2Cl--2 e-=Cl2↑ Cu2++2e-=2Cu CuCl2 Cu+Cl2 ↑ 电解 溶液中氢离子和氢氧根离子定向移动吗?为什么它们没有放电? 电解熔融氯化钠 熔融NaCl 阴极 阳极 e- e- Na+ Cl- 2Cl--2e-=Cl2↑ 2Na++2e- =2Na 氧化反应 还原反应 总反应:2NaCl=== 2Na+Cl2↑ 电解 1.电解 使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。 2.电解池(电解槽) 把电能转化为化学能的装置 注意:①电流应是直流点; ②熔融态的电解质也能被电解 一、电解原理 3.电解池构成条件 (1)外加直流电源 (2)电极 (3)电解质溶液或熔融电解质 阳极:接电源正极 阴极:接电源负极 惰性电极:C、Pt、Au等 活性电极:Fe、Cu、Ag等除C、Pt、Au的电极 电极 材料 名称 【小试牛刀】下图所示装置中,属于电解池的是_____(填序号)。 ③⑥ 写出用石墨做电极电解CuSO4溶液的电极反应式及总电解方程式 阴极: 阳极: ③两极反应式相加得总方程式 4OHˉ -4eˉ =O2↑+2H2O 2Cu2++4eˉ =2Cu OH->SO42ˉ H+ < Cu2+ ①首先分析、比较出阴阳极的放电离子 ②然后写电极反应式 : 电解 2CuSO4+2H2O 2Cu+O2↑+2H2SO4 电解 2Cu+O2↑+4H+ 2Cu2++2H2O 4.电极反应式的书写 阴极: 阳极: 来自弱电解质的离子用分子形式表示,否则仍写成离子。 阳极 阴极 氧气 氢 气 Na2SO4溶液 实例 电极反应 浓度 pH 复原 Na2SO4 阳极: 4OH--4e- =2H2O+O2 ↑ 阴极: 4H ++4e- =2H2 ↑ 变大 不变 加H2O 2H2O 2H2 ↑+O2 ↑ 电解 阳极 阴极 氯气 氢 气 NaCl溶液 实例 电极反应 浓度 pH 复原 NaCl 阳极: 2Cl- -2e- =Cl 2↑ 阴极: 2H ++2e- =H2 ↑ 2NaCl+2H2O 2NaOH+H2 ↑+Cl2 ↑ 电解 减小 增大 加HCl 实例 电极反应 浓度 pH值 复原 CuSO4 阳极 阴极 氧 气 铜 阳极: 4OH- -4e- =2H2O+O2 ↑ 阴极:Cu2++2e- =Cu 减小 减小 加CuO CuSO4溶液 2CuSO4+ 2H2O 2Cu+O2 ↑+2H2SO4 电解 阳极:S2->I- >Br- >Cl- >OH->含氧酸根>F- Ⅰ Ⅱ Ⅲ Ⅳ Ⅰ与Ⅲ区:电解本身型 如CuCl2 、HCl Ⅰ与Ⅳ区:放氢生碱型 如NaCl Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3 Ⅱ与Ⅳ区:电解水型 如Na2SO4、H2SO4 、NaOH 阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+ 电解规律(惰性电极) 1.写出下列装置中所发生的电极反应方程式 石墨 石墨 粗铜 纯铜 纯铜 铁 CuSO4溶液 (A) (B) (C) CuSO4溶液 CuSO4溶液 2.图中 、 分别是直流电源的两极,通电后发现 电极质量增加, 电极处有无色无味气体放出,符合这一情况的是( ) 选项 电极 电极 极 溶液的溶 ... ...