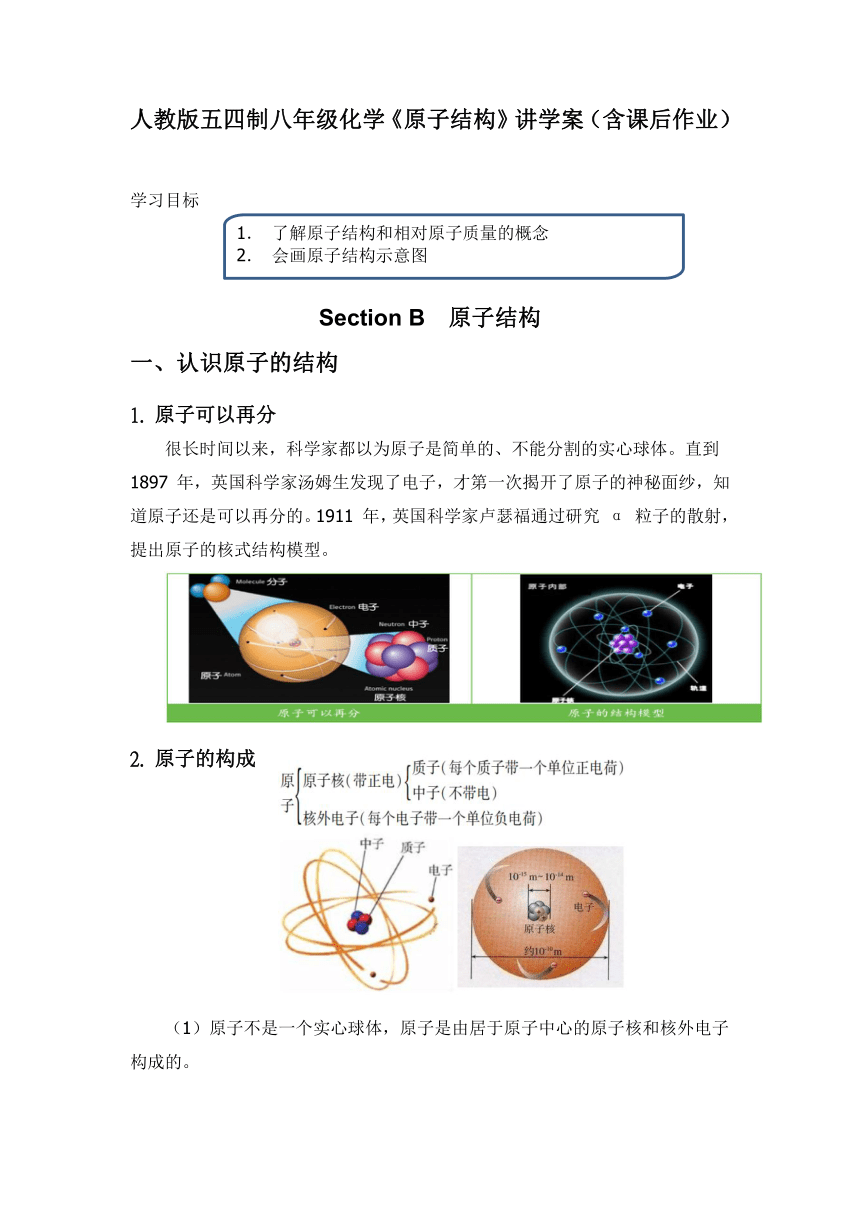
人教版五四制八年级化学《原子结构》讲学案(含课后作业) 学习目标 Section B 原子结构 一、认识原子的结构 1. 原子可以再分 很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。直到 1897 年,英国科学家汤姆生发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。1911 年,英国科学家卢瑟福通过研究 α 粒子的散射,提出原子的核式结构模型。 原子的构成 (1)原子不是一个实心球体,原子是由居于原子中心的原子核和核外电子构成的。 (2)原子核是由质子和中子构成的,每一个质子带一个单位的正电荷,中子不带电。 (3)原子核带正电荷,每一个电子带一个单位的负电荷。 3. 质子数、中子数、核电荷数、核外电子数的关系 (1)核电荷数:原子核所带的电荷数。 由于原子核是由质子和中子构成的(除氢原子),每一个质子带一个单位的正电荷,中子不带电,所以原子核所带的正电荷数(即核电荷数)等于质子数。 (2)原子中存在带电的粒子,但不显电性。 由于原子核内质子所带电荷数量与核外电子所带的电荷数量相等(即质子数等于核外电子数),电性相反,故原子不显电性。 (3)核电荷数=核内质子数=核外电子数,但质子数不一定等于中子数(如上表中的钠原子),并不是所有的原子都有中子(如上表中的氢原子)。 二、相对原子质量 1. 相对原子质量 (1)概念:以一种碳原子(碳 12,核内有 6 个质子和 6 个中子)的质量的 1/12 为标准,其他原子的质量跟它相比较所得的比,作为这种原子的相对原子质量(符号为Ar)。 (2)计算方法 注意:相对原子质量是有单位的,其国际单位为 1,一般不写。 (3)相对原子质量与原子中微粒数目关系 质子和中子的质量大致相等,相对碳-12 原子质量为 1; 电子质量很小,是质子质量的 1/1836,可以忽略不计; 整个原子的质量几乎集中在原子核上。 结论:相对原子质量≈质子数+中子数。 三、原子结构示意图 1. 核外电子排布 科学研究表明,能量低的电子在离核近的区域运动,能量高的电子在离核远的区域运动,这些不同区域称为电子层。由里到外,定义为第一~七层。在原子中,电子层并不真实存在,只是一种人为规定。 2.原子结果示意图 根据质子数得出核电荷数,写在圆圈中,并在数字前标上正号;从左往右依次用短弧线表示电子层,并标出每层所排电子数,第一层电子数不超过 2 个,第二层电子数不超过 8 个,最外层电子数不超过 8 个(只有一个电子层时最多 2 个电子)。 3. 原子的性质与最外层电子数的关系 由此可见,原子的性质,特别是原子的化学性质与原子的最外层上电子数有密切的关系。 典例精练 1.填空: 在分子、原子、离子、质子、中子、电子等粒子中,_____是化学变化中的最小粒子;可保持物质化学性质(由分子构成的物质)的粒子是_____;一定带正电的粒子是_____。在 原子中,原子的质量是由原子的_____决定的,质量最小的粒子是_____。 2.填写下列空格: 3.如图所示是钠原子的结构示意图,填空: (1)质子数是_____; (2)最外层电子数为_____; (3)核外有_____个电子层; (4)核外电子总数为_____; (5)钠原子_____(“易得”或“易失”)电子。 4.下列关于原子的说法,错误的是_____。 (1)原子核都由中子和质子构成 (2)在原子中,核电荷数一定等于质子数或核外电子数 (3)原子核带正电荷,因此原子整体显电性 (4)同类原子的质子数一定相同 (5)相对原子质量约等于质子数和中子数之和 (6)相对原子质量就是原子的实际质量 (7)相对原子质量是一个比值,在国际单位制中,单位为 1 (8)相对原子质量大的原子真实质量也大 勇攀高峰 1.聚变原理是两个氘原子核(核内含一个质子和一个中子)聚合成一个较重的氦原子核,从而释放出巨大的能 ... ...
~~ 您好,已阅读到文档的结尾了 ~~