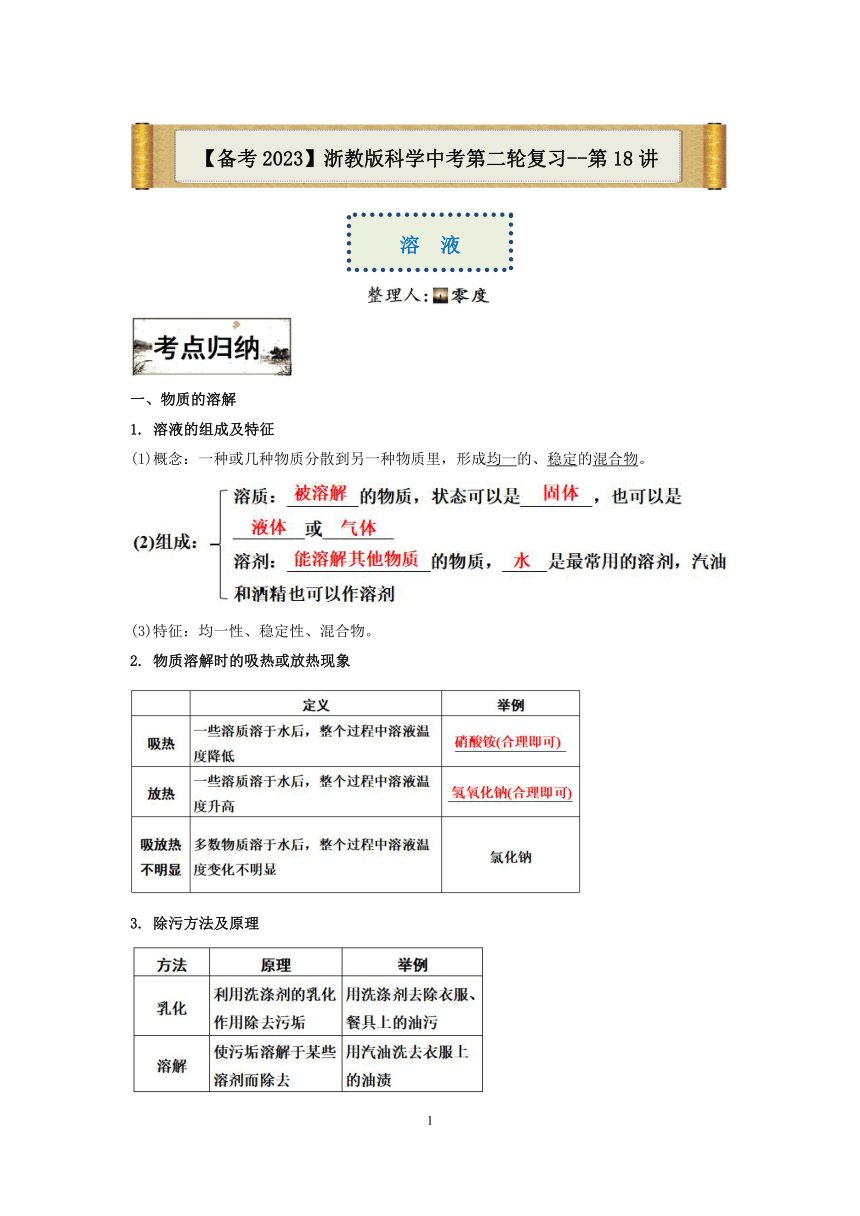
一、物质的溶解 1. 溶液的组成及特征 (1)概念:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物。 (3)特征:均一性、稳定性、混合物。 2. 物质溶解时的吸热或放热现象 3. 除污方法及原理 二、饱和溶液与不饱和溶液 1. 饱和溶液与不饱和溶液的判断 2. 饱和溶液和不饱和溶液的转化 (1)对于大多数固体(溶解度随温度升高而增大的物质,如KNO3): 三、溶解度及溶解度曲线 1. 固体的溶解度 (1)概念:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量,单位为“g”。 (2)影响因素,内因:溶质和溶质的性质;外因:温度。 (3)物质溶解度与溶解性的关系 四、溶质质量分数的计算 1. 溶质质量分数 2. 溶液稀释的计算 浓溶液的质量×浓溶液的溶质质量分数=稀溶液的质量×稀溶液的溶质质量分数 3.一定溶质质量分数溶液的配制 1. 仪器的选用及其作用 (1)所用仪器:托盘天平(带砝码)、镊子、药匙、量筒、胶头滴管、烧杯、玻璃棒。 说明:用浓溶液稀释配制时不需要的仪器是托盘天平、镊子、药匙。 (2)玻璃棒的作用是搅拌,加速溶解;量筒的作用是量取一定体积的液体, 选取量筒的量程要大于或等于量取液体的体积,且越接近越好;量取时在接 近所需体积时改用胶头滴管滴加。 2. 操作步骤 (1)用NaCl固体配制溶液 注:①溶质质量=溶液质量×溶质质量分数; ②溶剂质量=溶液质量-溶质质量 3. 实验偏差分析 例1、已知:(1)20℃时,溶解度在10克以上的物质称为易溶物质;溶解度在1~10克的物质为可溶物质;溶解度在0.01~1克为微溶物质;溶解度小于0.01克的物质为难溶物质。(2)20℃时几种物质的溶解度如下 物质名称 氯化钠 氢氧化钙 氯酸钾 硝酸钾 溶解度(克) 36.0 0.165 7.4 31.6 下列说法正确的是( ) A.20℃时氢氧化钙是难溶物质 B.20℃时可以配制出20%的硝酸钾溶液 C.20℃时氯酸钾是易溶物质 D.20℃时硝酸钾的溶解度比氯化钠大 例2、如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程, 可以作出的正确判断是( ) A.在①→②过程中,氯化钠的质量分数保持不变 B.在②→③过程中,氯化钠的溶解度不断增大 C.在③→④过程中,水的质量分数不断增大 D.在②→④过程中,氯化钠的质量分数先不变后增大 例3、硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( ) A.操作Ⅰ一定是加溶质 B.②与③的溶质质量分数可能相等 C.①与②的溶质质量可能相等 D.经过操作Ⅰ溶液的溶质质量分数一定增加 例4、甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( ) A.甲一定是不饱和溶液 B.丙和丁一定是饱和溶液 C.乙的溶质质量分数一定比甲大 D.甲和丙的溶质质量分数一定不相等 例5、同学们用固体M做了如图实验,图中甲、乙、丙、丁是充分搅拌后静置的现象,请回答相关问题(忽略水的蒸发)。 (1)上述烧杯中,溶液质量最大的是 (填序号)。 (2)小金同学认为乙烧杯中的溶液一定呈饱和状态,他这样判断的证据是 。 1.20℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是( ) A.甲烧杯中,硝酸钾溶液是不饱和溶液 B.丁烧杯中,硝酸钾溶液是不饱和溶液 C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大 D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大 2.如图为小明在实验室中模拟海水晒盐的过程,图中各烧杯中的液体一定属于饱和溶液的是( ) A.甲、乙 B.乙、丙 C.丙、丁 D.甲、丁 3.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

