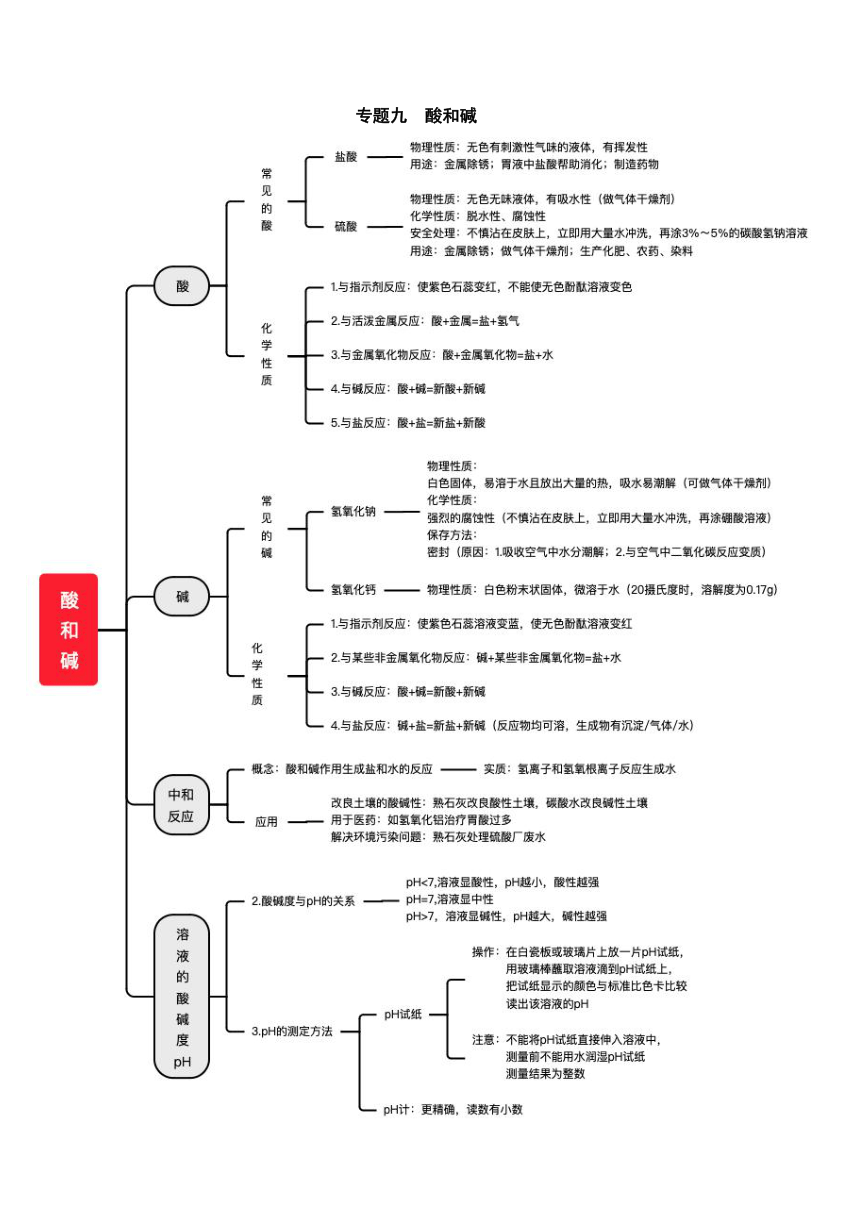
专题九 酸和碱 酸碱指示剂 1.概念:能跟酸或碱的溶液起作用而显示不同颜色的物质叫酸碱指示剂。 2.显色规律及应用 酸碱指示剂 酸性溶液 中性溶液 碱性溶液 变色规律 紫色石蕊溶液 红色 紫色 蓝色 酸红碱蓝 无色酚酞溶液 无色 无色 红色 遇碱变红 常见的酸 1.酸的定义:物质溶于水时,形成的阳离子全部是H+的化合物。 2.常见的酸:硫酸(H2SO4)、硝酸(HNO3)、醋酸(CH3COOH)、碳酸(H2CO3)等 3.盐酸和硫酸比较 浓硫酸 H2SO4 浓盐酸 HCl 色、态、味 无色黏稠的油状液体、无味 无色的液体、有刺激性气味 挥发性 无 有 吸水性 具有吸水性(物理性质) 不具有吸水性 用途 重要化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。 浓硫酸有吸水性,在实验室中常用它做干燥剂。 重要化工产品。用于金属表面除锈、制造药物(如盐酸麻黄素、氯化锌)等;人体胃液中有盐酸,可帮助消化。 (1)浓硫酸腐蚀性脱水性(化学性质): 它能夺取纸张、木材、布料、皮肤(都由含碳、氢、氧等元素的化合物组成)里的水分,生成黑色的炭。 (2)安全处理:不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液。稀硫酸沾在衣服上,水分蒸发后会变成浓硫酸,也要进行处理。 (3)浓硫酸的稀释 正确操作 操作要领: 酸入水,沿器壁,慢倾倒,及时搅; *浓硫酸溶于水放出大量热 错误操作 水倒入酸中放出大量热使水沸腾,酸液飞溅 *切不可把水注入浓硫酸! 酸的化学性质 1.酸有相同的化学性质是因为酸在水中都能电离出H+。 2.酸的化学性质 ①+酸碱指示剂 紫色石蕊溶液变红,无色酚酞不变色 使用点滴板进行实验优点: 操作简单、节约药品、 便于对照、效果较好。 ②+活泼金属 (置换反应) 铁和酸反应: Fe+2HCl=FeCl2+H2↑ Fe+H2SO4=FeSO4+H2↑ 现象:铁表面有气泡产生;溶液由无色逐渐变为浅绿色 锌和酸反应: Zn+2HCl = ZnCl2+H2↑ Zn+H2SO4 = ZnSO4+H2↑ 现象:固体逐渐溶解,产生气泡 ③+金属氧化物 (复分解反应) 氧化铁和酸反应: Fe2O3+6HCl = 2FeCl3+3H2O Fe2O3+3H2SO4 = Fe2(SO4)3+3H2O 现象:红色固体逐渐溶解,溶液由无色变为黄色 氧化铜和酸反应: CuO+2HCl = CuCl2+H2O CuO+H2SO4 = CuSO4+H2O 现象:黑色固体逐渐溶解,溶液由无色变为蓝色 ④+碱 (中和反应) HCl与NaOH反应: HCl+NaOH = NaCl+H2O H2SO4与Ca(OH)2反应: H2SO4+Ca(OH)2 = CaSO4+2H2O ⑤+某些盐 (复分解反应) HCl与CaCO3反应: 2HCl+CaCO3 = CaCl2+H2O+CO2↑ 现象:固体逐渐溶解,产生气泡 H2SO4与Na2CO3反应: H2SO4+Na2CO3 = Na2SO4+H2O+CO2↑ 现象:产生大量气泡 除硫酸钡的钡盐都能与硫酸反应:BaCl2+H2SO4=BaSO4↓+ 2HCl 硝酸银能与盐酸反应: AgNO3+HCl=HNO3+AgCl↓ 常见的碱 碱的定义:物质溶于水时,形成的阳离子全部是OH-的化合物。 氢氧化钠和氢氧化钙 碱 氢氧化钠(烧碱、火碱、苛性钠) 氢氧化钙(消石灰、熟石灰) 化学式 NaOH Ca(OH)2 制法 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ CaO+H2O=Ca(OH)2 状态 白色块状固体 白色粉末状固体 腐蚀性 强腐蚀性 如果不慎将氢氧化钠溶液沾到皮肤上,先用大量水冲洗,再涂上硼酸溶液。 较强腐蚀性 特点 易溶于水,时放出大量的热。 氢氧化钠固体易吸水而潮解。 微溶于水,溶于水时放热不明显。 鉴别 通入CO2,产生白色沉淀的为氢氧化钙 用途 制取肥皂、石油、造纸、纺织和印染工业,氢氧化钠能与油脂反应,所以可以除油污,实验室做气体的干燥剂。 做建筑材料、涂树木上防冻伤和防虫卵 改良酸性土壤和河流、配制波尔多液,在实验室中检验二氧化碳。 碱的化学性质 碱有相同的化学性质是因为不同的碱溶液中都含有相同的OH-。 ①+酸碱指示剂 碱溶液(四大强碱的溶液 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

