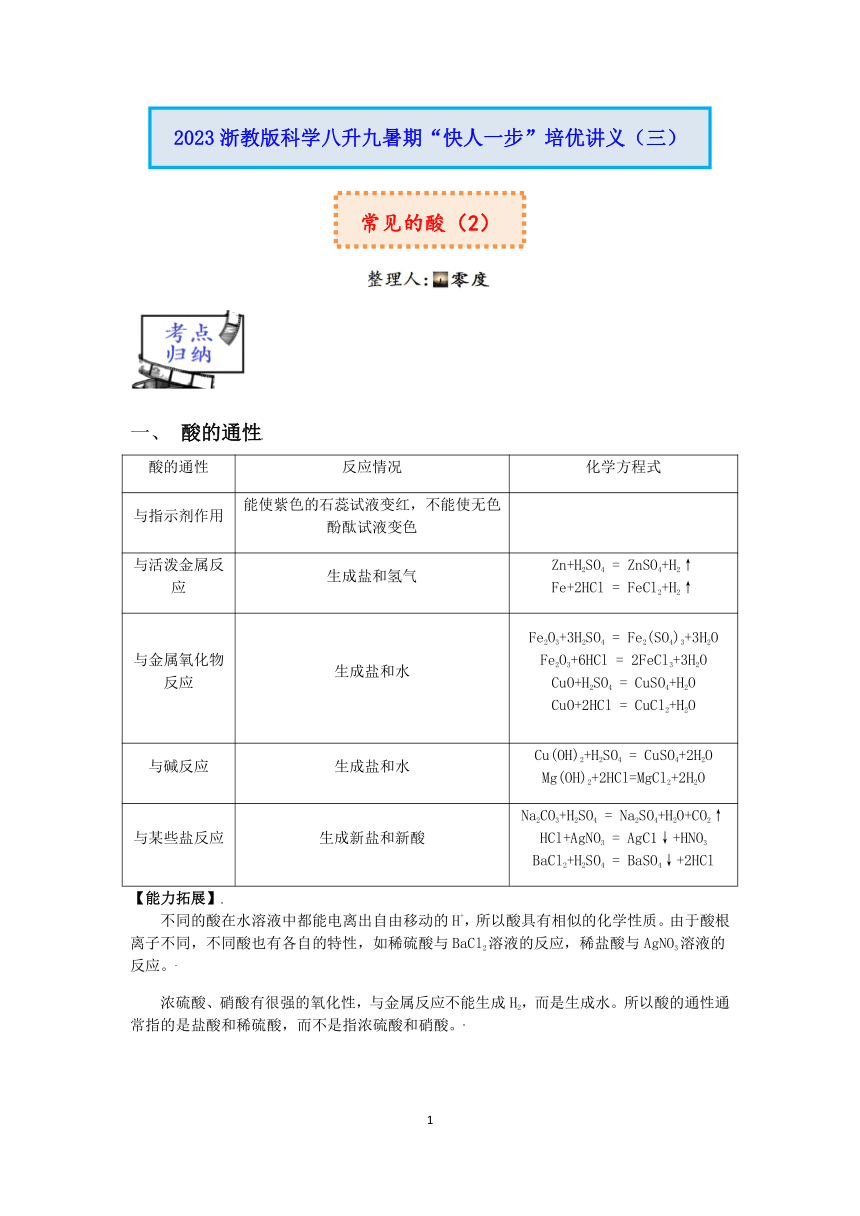
一、 酸的通性 酸的通性 反应情况 化学方程式 与指示剂作用 能使紫色的石蕊试液变红,不能使无色酚酞试液变色 与活泼金属反应 生成盐和氢气 Zn+H2SO4 = ZnSO4+H2↑Fe+2HCl = FeCl2+H2↑ 与金属氧化物反应 生成盐和水 Fe2O3+3H2SO4 = Fe2(SO4)3+3H2OFe2O3+6HCl = 2FeCl3+3H2OCuO+H2SO4 = CuSO4+H2OCuO+2HCl = CuCl2+H2O 与碱反应 生成盐和水 Cu(OH)2+H2SO4 = CuSO4+2H2OMg(OH)2+2HCl=MgCl2+2H2O 与某些盐反应 生成新盐和新酸 Na2CO3+H2SO4 = Na2SO4+H2O+CO2↑HCl+AgNO3 = AgC1↓+HNO3BaCl2+H2SO4 = BaSO4↓+2HCl 【能力拓展】 不同的酸在水溶液中都能电离出自由移动的H+,所以酸具有相似的化学性质。由于酸根离子不同,不同酸也有各自的特性,如稀硫酸与BaCl2溶液的反应,稀盐酸与AgNO3溶液的反应。 浓硫酸、硝酸有很强的氧化性,与金属反应不能生成H2,而是生成水。所以酸的通性通常指的是盐酸和稀硫酸,而不是指浓硫酸和硝酸。 二、Cl-和SO42-两种离子的检验 Cl-:先向待测液中滴加AgNO3溶液,出现白色沉淀后再滴加稀HNO3,沉淀不消失。 相关的化学方程式: HCl+AgNO3=AgCl↓+HNO3 (以HCl为例)。 SO42-:先向待测液中滴加Ba(NO3)2溶液,出现白色沉淀后再滴加稀HNO3,沉淀不消失。 相关的化学方程式:H2SO4+Ba(NO3)2=BaSO4↓+2HNO3(以H2SO4为例)。 例1、不能说明硫酸具有酸的通性的反应是( ) A.Zn+H2SO4═ZnSO4+H2↑ B.H2SO4+BaCl2═BaSO4↓+2HCl C.CuO+H2SO4═CuSO4+H2O D.H2SO4+2KOH═K2SO4+2H2O 例2、向一定量的硫酸溶液中,分别加入足量的水、金属锌、氢氧化钠溶液、氯化钡溶液,下列图示正确的是( ) A.加足量水 B.加足量锌 C.加足量NaOH溶液 D.加足量BaCl2溶液 例3、实验室用石灰石与稀盐酸反应制取二氧化碳,发生装置如图所示,从U形管注入稀盐酸,发现稀盐酸未能与有孔塑料板上的石灰石接触,但此时已无稀盐酸可加,则下列溶液中,最适宜添加的是( ) A.硝酸钠溶液 B.碳酸钠溶液 C.氢氧化钠溶液 D.氢氧化钙溶液 例4、向盛有100g稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算: (1)稀硫酸反应完时,产生氢气的质量为_____g (2)消耗金属锌的质量是多少克_____? (3)反应结束时溶液溶质的质量分数_____ 1.如图表示化学反应中溶液的颜色变化。下列叙述不正确的是( ) A.若X是稀盐酸,a可能是紫色石蕊试液 B.若X是稀盐酸,b可能是氧化物 C.若X是稀硫酸,c不可能是单质 D.若X是稀硫酸,d不一定是碱类物质 2.已知硫酸溶液中存在H+、SO42﹣和H2O,某同学欲证明能使石蕊试液变红的是硫酸溶液中的H+,设计了如图所示实验.下列组合能证明使石蕊试液变红的是硫酸溶液中的H+的是( ) A.②④ B.②③④ C.①② D.②③ 3.在学习硫酸的性质之后,为了加强记忆,小丽同学用如图形象的总结了硫酸能与五类物质发生反应,根据要求完成下列问题: (1)将紫色石蕊溶液滴入稀硫酸溶液中,紫色石蕊溶液遇稀硫酸变成_____; (2)稀硫酸能够除铁锈(铁锈的主要成分),反应的化学力程式_____; (3)为了验证反应⑤能够发生,应选择的物质是_____; A.NaCl溶液 B.NaOH溶液 C.溶液 D.溶液 (4)用废铁屑与废硫酸(的质量分数为20%)反应可制取硫酸亚铁,写出由废铁屑中铁制取硫酸亚铁的化学反应方程式_____。 4.无论在科学世界里,还是在日常生活中,酸是广泛存在而又非常重要的物质。下面对常见的酸———硫酸的部分性质进行探究。 (1)浓硫酸的特性 ①向一个烧杯中加入一定质量的浓硫酸,总质量为m1;敞口放置在空气中一段时间后,总质量为m2,那么m1_____m2(选填“>” “=”或“<”)。 ②如图 ... ...
~~ 您好,已阅读到文档的结尾了 ~~