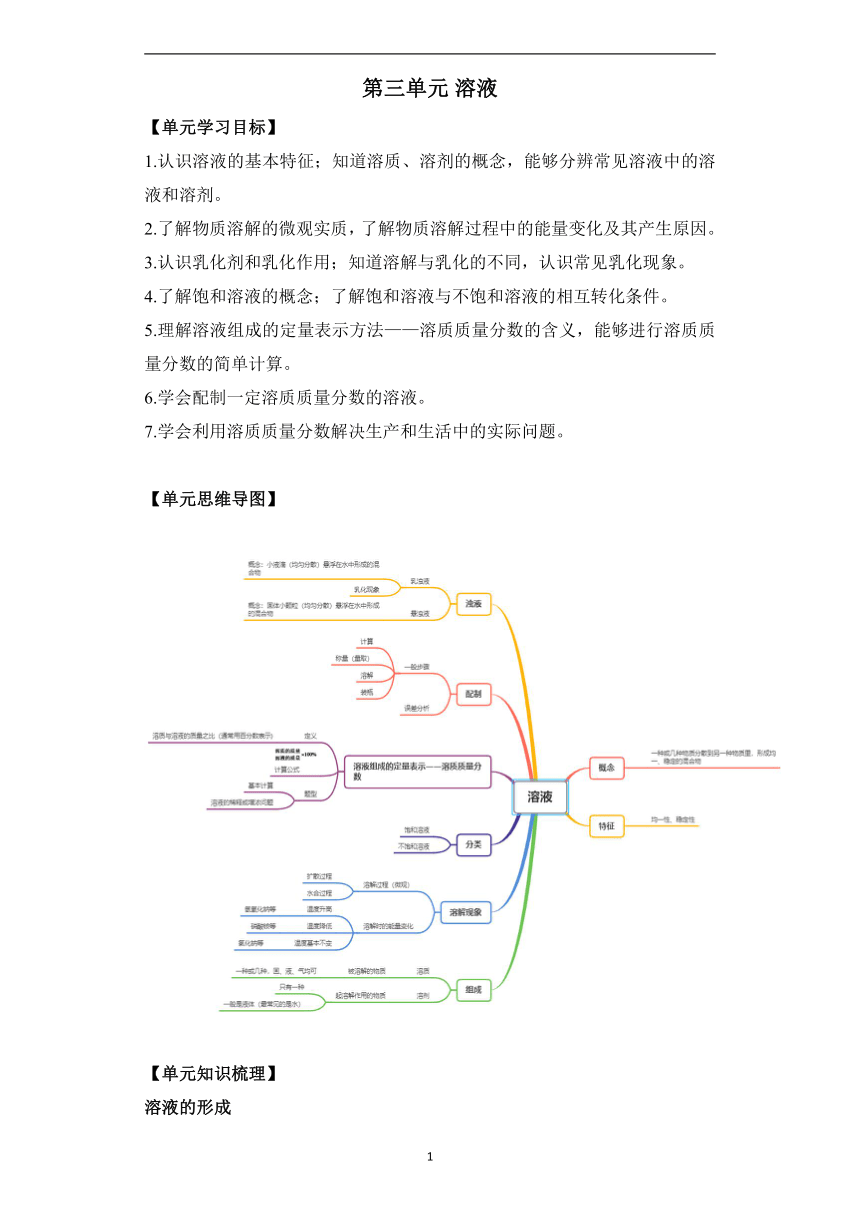
第三单元 溶液 【单元学习目标】 1.认识溶液的基本特征;知道溶质、溶剂的概念,能够分辨常见溶液中的溶液和溶剂。 2.了解物质溶解的微观实质,了解物质溶解过程中的能量变化及其产生原因。 3.认识乳化剂和乳化作用;知道溶解与乳化的不同,认识常见乳化现象。 4.了解饱和溶液的概念;了解饱和溶液与不饱和溶液的相互转化条件。 5.理解溶液组成的定量表示方法———溶质质量分数的含义,能够进行溶质质量分数的简单计算。 6.学会配制一定溶质质量分数的溶液。 7.学会利用溶质质量分数解决生产和生活中的实际问题。 【单元思维导图】 【单元知识梳理】 溶液的形成 溶液 (1)溶液的定义:一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物。 (2)溶液的特征:均一性、稳定性。 (3)溶液的组成:由溶质和溶剂组成。 (4)质量关系:溶液质量=溶质质量+溶剂质量 (5)体积关系:溶液的体积<溶质的体积+溶剂的体积 2、溶质、溶剂的判断 (1)根据溶液的名称判断。溶液的完整名称是:“溶质名称”的“溶剂的名称”溶液;若溶剂是水,可命名为:“溶质名称”溶液;“个别俗称如石灰水(氢氧化钙的水溶液)、碘酒(碘的酒精溶液)、食盐水(氯化钠的水溶液)、医用酒精(75%的酒精的水溶液)。 (2) 溶液的组成 溶液的形成 溶质 溶剂 固体+液体 固体+液体 固体+液体 固体 固体 固体 液体 液体 液体 气体+液体 气体+液体 气体+液体 3、溶解时的热量变化 (1)有些物质溶于水时会放出热量(溶液温度升高),如氢氧化钠。 (2)有些物质溶于水时会吸收热量(溶液温度降低),如硝酸铵。 大多数物质溶于水时没有明显的温度变化,如氯化钠。 乳化作用 当在植物油中加入洗涤剂后,植物油就被分散成无数细小的液滴,而不能聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强,这种现象被称为乳化作用。肥皂、洗发水等都具有乳化作用。 【注意】 乳化与溶解不同,乳化是将难溶性液体物质分散成细小的液滴,而溶解是将可溶性物质分散成分子、离子等。 饱和溶液与不饱和溶液 概念 在一定温度下,向一定量溶剂里加人某种溶质,当溶质不能继续溶解时,所得的溶液叫作这种溶质的饱和溶液;还能继续溶解的溶液,叫作这种溶质的不饱和溶液。 【注意】 某种物质的饱和溶液中,不能继续溶解该物质,但还能够溶解其他物质,如在饱和硝酸钾溶液中可以溶解氯化钠。 相互转化 (1)对于大多数溶解度随温度升高而增大的固体物质: 饱和溶液不饱和溶液 (2)对于少数溶解度随温度升高而减小的固体物质[如Ca(OH)2]: 饱和溶液不饱和溶液 溶液的浓度 1、溶质质量分数 (1)定义:溶液中溶质的质量分数是溶质质量与溶液质量之比。 (2)公式 溶质的质量分数= 【注意】 ①溶质的质量分数必须用百分数表示,不能用分数或小数表示。 ②溶质质量指已溶解在溶剂里的溶质的质量,不一定等于加入的溶质质量(即没有溶解的部分不计入溶质质量)。 ③溶液是混合物,必须换成溶质的质量代入化学方程式才能进行计算。 2、溶液的稀释 (1)依据:溶液稀释前后,溶质的质量不变。 (2)公式 浓溶液质量×浓溶液溶质质量分数=稀溶液质量×稀溶液溶质质量分数 配制一定溶质质量分数的溶液 仪器的选用及各仪器的作用 (1)所用仪器:托盘天平(带砝码)、药匙(溶质为固体时)、量筒、胶头滴管、烧杯、玻璃棒。 (2)玻璃棒的作用:搅拌,加快固体或液体溶质的溶解速率。 (3)量筒的作用:量取一定体积的液体。选取量筒时量程要比量取液体的体积略大,且越接近越好。 2、操作步骤 所配制溶液的溶质为固体(如图所示)。 (1)计算:计算所需溶质的质量和水的体积。 (2)称量:用托盘天平称取一定质量的固体。 (3)量取:用量筒量取一定体积 ... ...
~~ 您好,已阅读到文档的结尾了 ~~