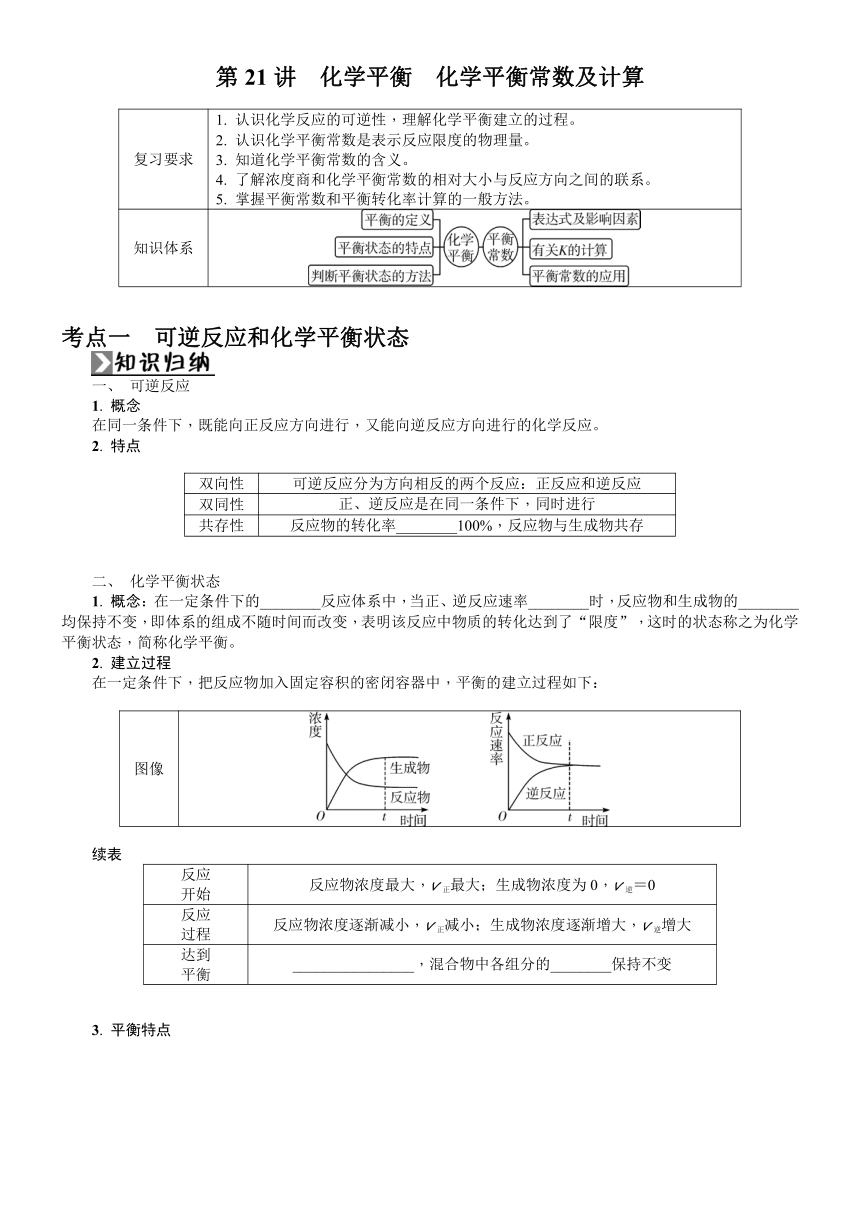
第21讲 化学平衡 化学平衡常数及计算 复习要求 1. 认识化学反应的可逆性,理解化学平衡建立的过程。2. 认识化学平衡常数是表示反应限度的物理量。3. 知道化学平衡常数的含义。4. 了解浓度商和化学平衡常数的相对大小与反应方向之间的联系。5. 掌握平衡常数和平衡转化率计算的一般方法。 知识体系 考点一 可逆反应和化学平衡状态 一、 可逆反应 1. 概念 在同一条件下,既能向正反应方向进行,又能向逆反应方向进行的化学反应。 2. 特点 双向性 可逆反应分为方向相反的两个反应:正反应和逆反应 双同性 正、逆反应是在同一条件下,同时进行 共存性 反应物的转化率_____100%,反应物与生成物共存 二、 化学平衡状态 1. 概念:在一定条件下的_____反应体系中,当正、逆反应速率_____时,反应物和生成物的_____均保持不变,即体系的组成不随时间而改变,表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态,简称化学平衡。 2. 建立过程 在一定条件下,把反应物加入固定容积的密闭容器中,平衡的建立过程如下: 图像 续表 反应开始 反应物浓度最大,v正最大;生成物浓度为0,v逆=0 反应过程 反应物浓度逐渐减小,v正减小;生成物浓度逐渐增大,v逆增大 达到平衡 _____,混合物中各组分的_____保持不变 3. 平衡特点 4. 化学平衡状态的判断 (1)动态标志: v正=v逆≠0 (2)静态标志:各种“量”不变 ①各物质的质量、物质的量或浓度不变。 ②各物质的百分含量(物质的量分数、质量分数等)不变。 ③压强(化学反应方程式两边气体体积不相等)或颜色(某组分有颜色)不变。 ④绝热容器中温度不变。 ⑤密度(ρ=)不变(注意容器中的气体质量和体积变化)。 ⑥平均相对分子质量(M=)不变(注意气体质量与气体物质的量变化)。 总之,可以利用平衡建立过程中“变量不变”作为判定标志。“不变量不变”不能作为判定标志。 【易错辨析】 1. 在化学平衡建立过程中,v正一定大于v逆。( ) 2. H2(g)+I2(g)2HI(g),体系中c(H2)∶c(I2)∶c(HI)=1∶1∶2,说明该反应达到平衡状态。( ) 3. (2024·苏州期中)4NH3(g)+5O2(g)4NO(g)+6H2O(g),断裂1 mol N—H的同时形成1 mol H—O,说明反应达到平衡状态。( ) 4. (2024·宝应期末)将等浓度、等体积的KHSO3溶液与FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红色,证明该反应存在一定限度。( ) 5. (2024·如东期中)取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1 FeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应。( ) (2024·海安期中)制水煤气的反应为C(s)+H2O(g)CO(g)+H2(g) ΔH>0,现将一定量的原料充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应,不能说明该反应达到化学平衡状态的是( ) A. CO与H2的物质的量之比不变 B. H2的体积分数不再发生变化 C. 混合气体压强保持不变 D. 混合气体的密度不变 考点二 化学平衡常数及计算 一、 化学平衡常数 1. 平衡常数的相关概念及影响因素 2. 化学平衡常数的计算 (1)“三段式”法计算平衡常数K K=(V为容器容积) (2)压强平衡常数(Kp) ①以为例,Kp=[p(X):X在平衡体系中物质的量分数(或体积分数)×总压强]。 ②计算方法 a. 根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度。 b. 计算各气体组分的物质的量分数或体积分数。 c. 根据分压计算公式求出各气体物质的分压,某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)。 d. 根据平衡常数计算公式代入计算。 例:设平衡时总压为p0。 平衡时p(N2)=p0、p(H2)=p0、p(NH3)=p0。 Kp==eq \f(16,3p)。 (3)速率常数与平衡常数 对于基元反应,v正=k正·ca(A)·cb(B),v逆=k逆· ... ...
~~ 您好,已阅读到文档的结尾了 ~~