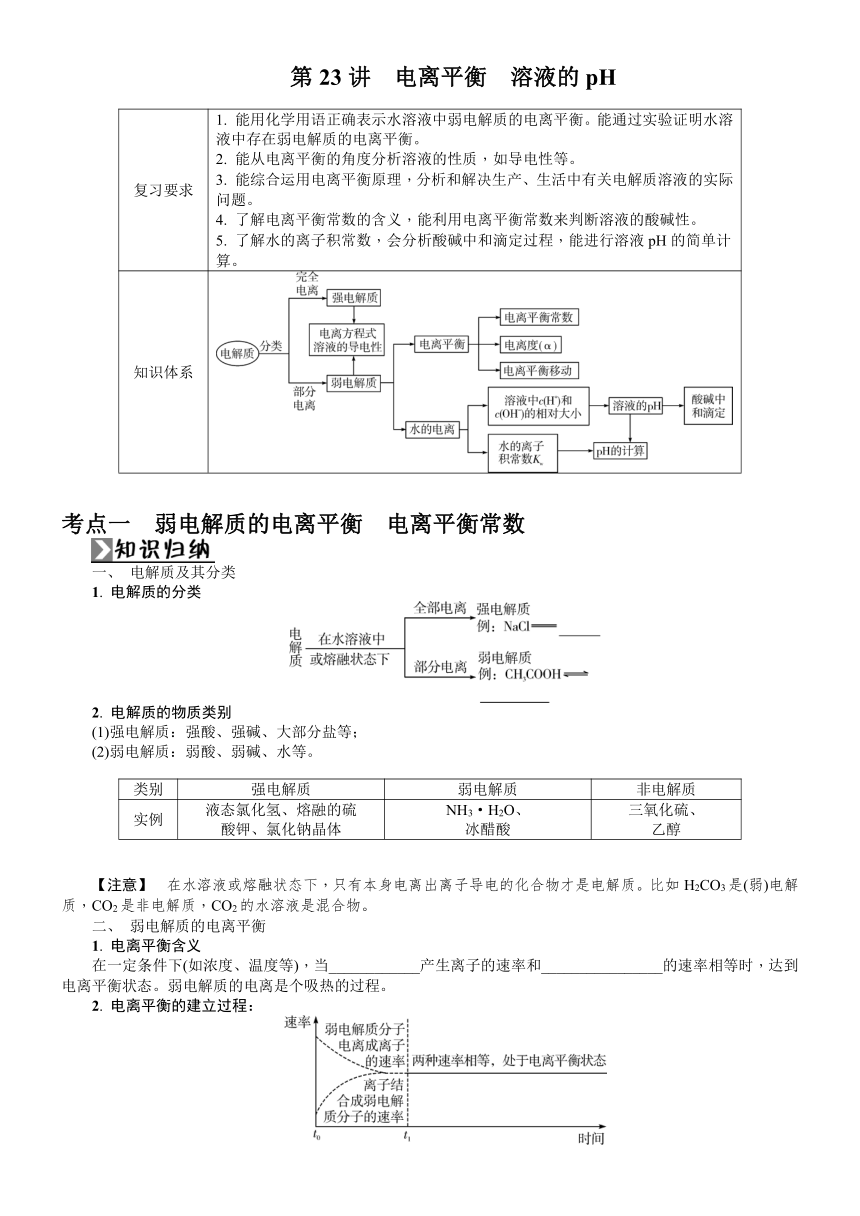
第23讲 电离平衡 溶液的pH 复习要求 1. 能用化学用语正确表示水溶液中弱电解质的电离平衡。能通过实验证明水溶液中存在弱电解质的电离平衡。2. 能从电离平衡的角度分析溶液的性质,如导电性等。3. 能综合运用电离平衡原理,分析和解决生产、生活中有关电解质溶液的实际问题。4. 了解电离平衡常数的含义,能利用电离平衡常数来判断溶液的酸碱性。5. 了解水的离子积常数,会分析酸碱中和滴定过程,能进行溶液pH的简单计算。 知识体系 考点一 弱电解质的电离平衡 电离平衡常数 一、 电解质及其分类 1. 电解质的分类 2. 电解质的物质类别 (1)强电解质:强酸、强碱、大部分盐等; (2)弱电解质:弱酸、弱碱、水等。 类别 强电解质 弱电解质 非电解质 实例 液态氯化氢、熔融的硫酸钾、氯化钠晶体 NH3·H2O、冰醋酸 三氧化硫、乙醇 【注意】 在水溶液或熔融状态下,只有本身电离出离子导电的化合物才是电解质。比如H2CO3是(弱)电解质,CO2是非电解质,CO2的水溶液是混合物。 二、 弱电解质的电离平衡 1. 电离平衡含义 在一定条件下(如浓度、温度等),当_____产生离子的速率和_____的速率相等时,达到电离平衡状态。弱电解质的电离是个吸热的过程。 2. 电离平衡的建立过程: 3. 影响电离平衡的因素 (1)内因 弱电解质本身的性质。 (2)外因 ①浓度:在一定温度下,同一弱电解质溶液,浓度越_____,越易电离。 ②温度:温度越_____,电离程度越_____。 ③同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。 ④化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。 三、 电离平衡常数及其应用 1. 概念 在一定条件下,弱电解质达到电离平衡时,溶液中电离所生成的各种离子浓度(幂次方)的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,简称电离常数,用_____(弱酸用_____,弱碱用_____)表示。 2. 电离平衡常数表达式 (1)一元弱酸或弱碱 一元弱酸HA 一元弱碱BOH 电离方程式 HA??H++A- BOH??B++OH- 电离常数表达式 Ka= Kb= (2)多元弱酸(以H2CO3为例) 第一步电离 第二步电离 电离方程式 _____ _____ 电离常数表达式 Ka1=eq \f(c(H+)·c(HCO),c(H2CO3)) Ka2=eq \f(c(H+)·c(CO),c(HCO)) 电离常数关系 Ka1_____Ka2 【思维拓展】 常见弱电解质的数据(25 ℃) ①电离是吸热过程。电离常数K只与_____有关,_____升高,K增大。 ②由以上数据可看出Ka1>Ka2>Ka3,且Ka1 Ka2,说明多元弱酸是分步电离的,且以_____电离为主。 ③电离常数K反映了弱电解质电离程度的相对大小。相同条件(同温、同浓度)下,电离常数K越大,表示弱电解质越容易电离,酸性(或碱性)越强。由以上表格数据可知,25 ℃时酸性由强到弱的是H3PO4>H2C2O4>HC2O>CH3COOH>H2CO3>HClO>HCO。 3. 利用电离平衡常数大小进行的比较 比较 举例 判断弱酸(或弱碱)酸性(或碱性)的相对强弱 Ka(HF)>Ka(HClO);同条件时的酸性:HF>HClO 判断酸与盐能否反应(强酸制弱酸) Ka1(H2CO3)>Ka(HClO);Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO 判断溶液中粒子浓度比值的变化 向NH4Cl溶液中加水稀释时,eq \f(c(NH3·H2O)·c(H+),c(NH))的变化:分子分母同时乘以c(OH-),可得,该比值只与温度有关,温度不变,比值不变 判断盐溶液的酸性(或碱性)强弱 K(HF)>K(CH3COOH);盐所对应的酸(或碱)越弱,盐的水解程度越大,盐的碱(或酸)性越强;同浓度时,溶液的碱性:NaF
~~ 您好,已阅读到文档的结尾了 ~~