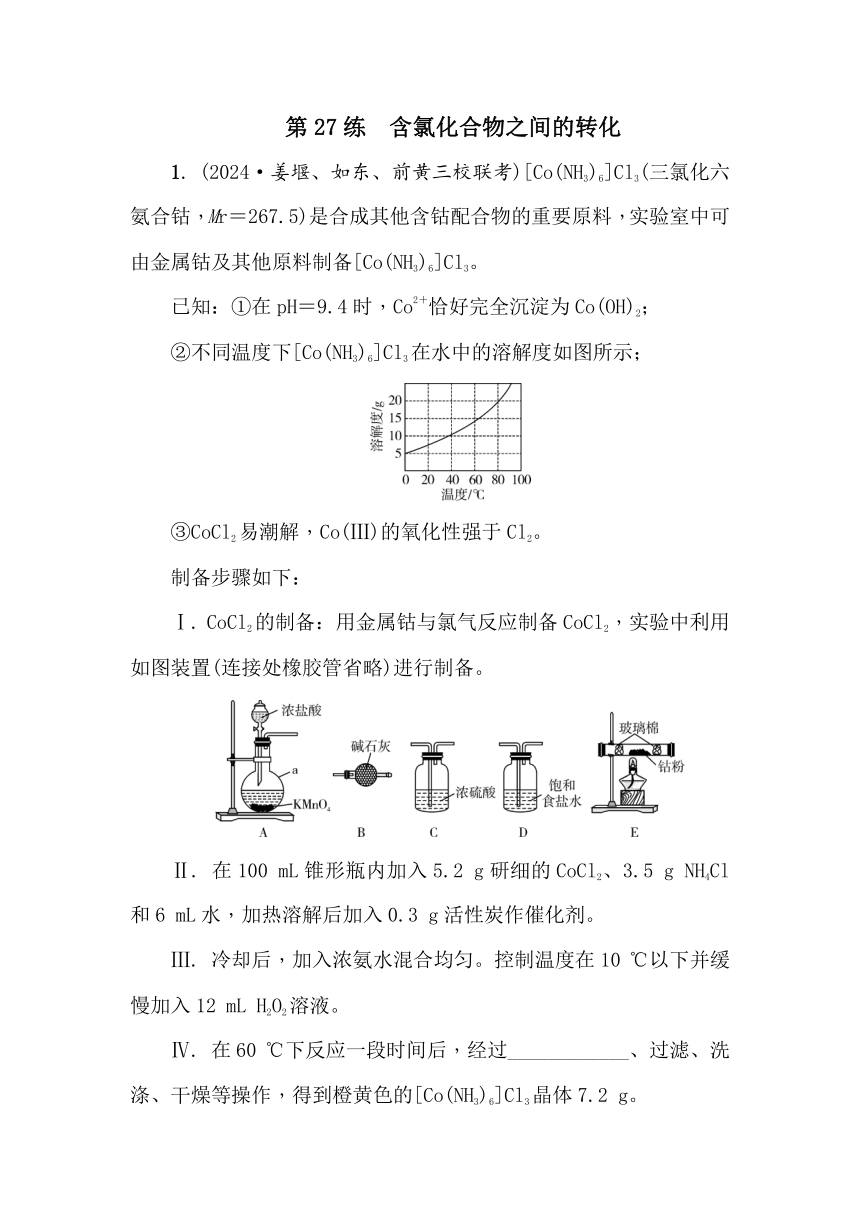
第27练 含氯化合物之间的转化 1. (2024·姜堰、如东、前黄三校联考)[Co(NH3)6]Cl3(三氯化六氨合钴,Mr=267.5)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备[Co(NH3)6]Cl3。 已知:①在pH=9.4时,Co2+恰好完全沉淀为Co(OH)2; ②不同温度下[Co(NH3)6]Cl3在水中的溶解度如图所示; ③CoCl2易潮解,Co(Ⅲ)的氧化性强于Cl2。 制备步骤如下: Ⅰ. CoCl2的制备:用金属钴与氯气反应制备CoCl2,实验中利用如图装置(连接处橡胶管省略)进行制备。 Ⅱ. 在100 mL锥形瓶内加入5.2 g研细的CoCl2、3.5 g NH4Cl和6 mL水,加热溶解后加入0.3 g活性炭作催化剂。 Ⅲ. 冷却后,加入浓氨水混合均匀。控制温度在10 ℃以下并缓慢加入12 mL H2O2溶液。 Ⅳ. 在60 ℃下反应一段时间后,经过_____、过滤、洗涤、干燥等操作,得到橙黄色的[Co(NH3)6]Cl3晶体7.2 g。 请回答下列问题: (1)仪器a的名称为_____。 (2)用图中的装置组合制备CoCl2,仪器的连接顺序为_____。装置B的作用是_____。 (3)制备三氯化六氨合钴的反应方程式为_____。 (4)在制备[Co(NH3)6]Cl3时,加入浓氨水前,需在步骤Ⅱ中加入NH4Cl,请结合平衡移动原理解释原因_____。 (5)步骤Ⅲ中在加入H2O2溶液时,控制温度在10 ℃以下缓慢加入的目的是_____。 (6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为_____、_____。 (7)制得[Co(NH3)6]Cl3产品的产率为_____%(精确到0.1%)。 2. 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: 已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出产品NaClO2·3H2O; ②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。 (1)发生器中鼓入空气的作用可能是_____。 a. 将SO2氧化成SO3,增强酸性 b. 将NaClO3还原为ClO2 c. 稀释ClO2以防止爆炸 (2)吸收塔内发生反应的化学方程式为_____。 (3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是_____(填序号)。 a. Na2O2 b. Na2S c. FeCl2 (4)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是_____(填序号)。 a. 蒸馏 b. 蒸发 c. 灼烧 d. 过滤 e. 冷却结晶 (5)某学习小组用碘量法测定粗产品中亚氯酸钠的含量,实验如下: a. 准确称取所得亚氯酸钠样品m g于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应,将所得混合液配成250 mL待测溶液。(已知:ClO+4I-+4H+===2H2O+2I2+Cl-) b. 移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定至终点,重复2次,测得平均值为V mL。(已知:I2+2S2O===2I-+S4O) ①达到滴定终点时的现象为_____。 ②该样品中NaClO2的质量分数为_____(用含m、c、V的代数式表示,结果化成最简) 3. (2025·江宁高三期中)FeCl3是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。。 已知:FeCl3易升华、遇水蒸气易潮解。 (1)A中反应的化学方程式为_____。该反应中,浓盐酸表现的性质是_____(填“氧化性”“还原性”或“酸性”)。 (2)B中的试剂是_____。C的作用是_____。 (3)E装置中冰水浴的作用是_____。 (4)F中反应的离子方程式为_____。 (5)上述实验装置存在两处缺陷:一是_____;二是_____。 (6)经改进,继续完成实验。实验完毕后,取产品探究其性质: 实验 操作 现象 ① 取少量固体溶于蒸馏水,滴加KSCN溶液 溶液变红色 ② 取少量固体溶于稀硫酸 固体溶解,无气泡产生 根据上述实验现象,_____(填“能”或“不能”)确定产品中是否含有铁单质,理由是_____(用文字描述)。 ... ...
~~ 您好,已阅读到文档的结尾了 ~~