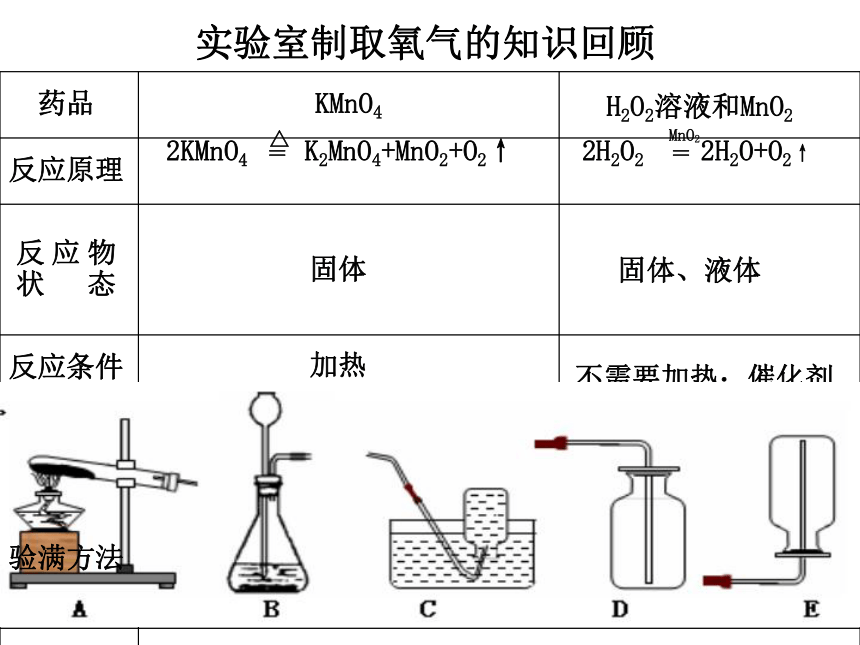
课件50张PPT。实验室制取氧气的知识回顾 ABC或D 用带火星的木条伸进瓶内,木条复燃,该气体是氧气用带火星的木条放在瓶口,木条复燃,则氧气已满。 固体加热固体、液体不需要加热;催化剂2KMnO4 K2MnO4+MnO2+O2↑2H2O2 2H2O+O2↑验满方法==△MnO2课题2 二氧化碳制取的研究一·实验室制取CO2的反应原理石蜡+氧气 二氧化碳+水不能;制得气体可能不纯不能;制得气体可能不纯不能;条件较难满足不能;条件较难满足生成二氧化碳的反应能否用于实验室里制取二氧化碳及理由点燃 列举你所知道的能生成二氧化碳的反应,与同学讨论这些反应能否用于在实验室里制取二氧化碳,并说明理由? 科学家研究发现: 凡是含碳酸根离子(CO32-)的化合物都能与稀盐酸(HCl)或稀硫酸 (H2SO4)等在常温下反应生成CO2气体。 生产生活中常见的石灰石、大理石、蛋壳、贝壳、水垢等其主要成分都是碳酸钙(CaCO3),纯碱是碳酸钠(Na2CO3),小苏打是碳酸氢钠(NaHCO3) 实验室制二氧化碳的理想原料可供选择的原料有: 石灰石(主要成分CaCO3) 碳酸钠粉末(Na2CO3) 稀盐酸(有效成分HCl) 稀硫酸(有效成分H2SO4) 注意事项: (1)注意仪器的使用和药品的取用 (2)重点比较反应速率的快慢 ① ② ③ ④ ★注意:①将半药匙碳酸钠、两至三粒石灰石分别放入四支试管中;③观察的重点是比较四个反应中的稀盐酸或稀硫酸;②向四支试管中分别倒入1/5试管气泡产生的快慢。反应原理的选择选用的药品有大量气泡产生,反应剧烈 有大量气泡产生,反应剧烈 反应速率太快,不易收集 反应速率太快,不易收集 产生气泡速率比较适中 适合实验室制取二氧化碳气体有气泡产生,会减慢,停止 反应速率慢,不易收集 实验室制取二氧化碳气体的最佳反应是: 3。实验室制取二氧化碳的反应原理●药 品●化学方程式CaCO3+2HCl=CaCl2+H2CO3H2CO3=H2O+CO2↑H2CO3石灰石(大理石)稀盐酸主要成分主要成分CaCO3HClCaCO3+2HCl = CaCl2+H2O+CO2↑稀硫酸与大理石(或石灰石)反应现象分析刚开始有大量气泡产生,一时间后,气泡逐渐 减少 ,反应逐渐停止。虽然该反应能生成二氧化碳: CaCO3+H2SO4==CaSO4+H2O+CO2 但生成的CaSO4微溶于水,覆盖在大理石表面, 形成一层薄膜,使大理石与酸不能接触,反应难 以进行。结论实验室制取二氧化碳能不能用稀硫酸代替稀盐酸 稀盐酸与碳酸钠粉未反应现象分析结论反应非常剧烈,短时间产生大量气泡碳酸钠粉未的表面积很大,与盐酸接触面积大, 反应速度很快,不易控制实验室不能用碳酸钠粉未或大理石粉未等粉未状 物质制取二氧化碳该反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2 实验室制取二氧化碳能不能用浓盐酸代替稀盐酸? 不能。因为浓盐酸有强烈的挥发性,会挥发出氯化氢气体,使制得的二氧化碳不纯。实验室制取气体的装置气体发生装置气体收集装置反应物的状态固体和固体反应固体和液体反应液体和液体反应反应条件(是否需要加热、加催化剂等)。。。二、设计实验室制取气体的装置排空气法密度比空气的大———向上排空气法密度比空气的小———向下排空气法排水法(不易溶于水、不与水发生反应)O2固+液常温稍大不易溶于水,且不与水反应固加热实验室制取氧气的发生装置和收集装置1、实验室制取气体的装置由哪几部分组成?两部分装置: 一、发生装置 二、收集装置2、确定气体发生装置时应考虑哪些因素?发生装置的确定需考虑的因素: 1、反应物的状态(如液态、固态) 2、反应条件(如加热,不加热)反应物是固体且需加热反应物有两种(固体+液体)且不需加热3、收集气体一般有哪些方法?一般有两种: 排空气法(1)向上排空气法(2)向下排空气法 排水法4、确定收集装置时应考虑哪些因素?主要应以两个物理性质方面去考虑 (1 ... ...
~~ 您好,已阅读到文档的结尾了 ~~