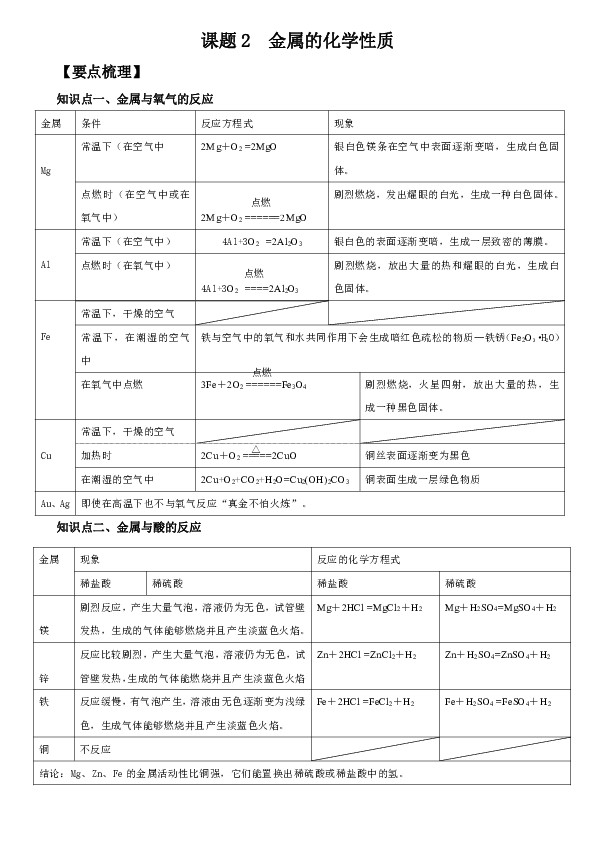
课题2 金属的化学性质 【要点梳理】 知识点一、金属与氧气的反应 金属 条件 反应方程式 现象 Mg 常温下(在空气中 2Mg+O2 =2MgO 银白色镁条在空气中表面逐渐变暗,生成白色固体。 点燃时(在空气中或在氧气中) 2Mg+O2 ======2MgO 剧烈燃烧,发出耀眼的白光,生成一种白色固体。 Al 常温下(在空气中) 4Al+3O2 =2Al2O3 银白色的表面逐渐变暗,生成一层致密的薄膜。 点燃时(在氧气中) 4Al+3O2 ====2Al2O3 剧烈燃烧,放出大量的热和耀眼的白光,生成白色固体。 Fe 常温下,干燥的空气 常温下,在潮湿的空气中 铁与空气中的氧气和水共同作用下会生成暗红色疏松的物质—铁锈(Fe2O3·H2O) 在氧气中点燃 3Fe+2O2 ======Fe3O4 剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。 Cu 常温下,干燥的空气 加热时 2Cu+O2 =====2CuO 铜丝表面逐渐变为黑色 在潮湿的空气中 2Cu+O2+CO2+H2O=Cu2(OH)2CO3 铜表面生成一层绿色物质 Au、Ag 即使在高温下也不与氧气反应“真金不怕火炼”。 知识点二、金属与酸的反应 金属 现象 反应的化学方程式 稀盐酸 稀硫酸 稀盐酸 稀硫酸 镁 剧烈反应,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能够燃烧并且产生淡蓝色火焰。 Mg+2HCl =MgCl2+H2 Mg+H2SO4=MgSO4+H2 锌 反应比较剧烈,产生大量气泡,溶液仍为无色,试管壁发热,生成的气体能燃烧并且产生淡蓝色火焰 Zn+2HCl =ZnCl2+H2 Zn+H2SO4=ZnSO4+H2 铁 反应缓慢,有气泡产生,溶液由无色逐渐变为浅绿色,生成气体能够燃烧并且产生淡蓝色火焰。 Fe+2HCl =FeCl2+H2 Fe+H2SO4 =FeSO4+H2 铜 不反应 结论:Mg、Zn、Fe的金属活动性比铜强,它们能置换出稀硫酸或稀盐酸中的氢。 知识点三、置换反应 置换反应:由一种单质与一种化合物反应,生成另一种单质与化合物的反应叫做置换反应。 如:Mg+2HCl =MgCl2+H2 Fe+2HCl =FeCl2+H2 Fe+CuSO4= Cu+FeSO4 知识点四、金属活动性顺序 人们通过大量的实验验证得到常见金属的活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au 金属活动性:由强到弱 1. 在金属活动性顺序里,金属的位置越靠前,它的活动性越强。 2. 在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。 3. 在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来(K、Ca、Na除外)。 实验操作 现象 反应的化学方程式 铁丝浸入硫酸铜溶液中 浸入溶液的铁钉表面覆盖一层紫红色的物质,溶液由蓝色逐渐变为浅绿色 Fe+CuSO4= Cu+FeSO4 【典型例题】 1、铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。铝具有良好抗腐蚀性能的原因是 ( ) A.铝的化学性质不活泼 B.铝不与酸、碱反应 C.铝常温下不与氧气反应 D.铝表面生成一层致密的氧化铝保护膜 2、将金属锰(Mn)投入稀盐酸中,有气泡产生。将镁条插入硫酸锰溶液中,如果有锰析出,则Mn、Mg、Cu的金属活泼性由强到弱的顺序是 ( ) A.Mn、Mg、Cu B.Mg、Mn、Cu C.Cu、Mg、Mn D.Cu、Mn、Mg 3、将一小块Na投入足量的CuSO4溶液中,现象是( ) A、置换出金属铜 B、产生气体,置换出金属铜 C、生成蓝色沉淀 D、产生气体,生成蓝色沉淀 举一反三: 1、有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放人硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( ) A.Z、Y、X B.X、Y、Z C.Y、X、Z D.X、Z、Y 2、下列四个实验中只需要完成三个就可以证明Fe、Cu、Ag三种金属的活动性顺序。其中不必进行的是( ) A.将铁片放入稀盐酸 B.将铜片放入稀盐 ... ...
~~ 您好,已阅读到文档的结尾了 ~~