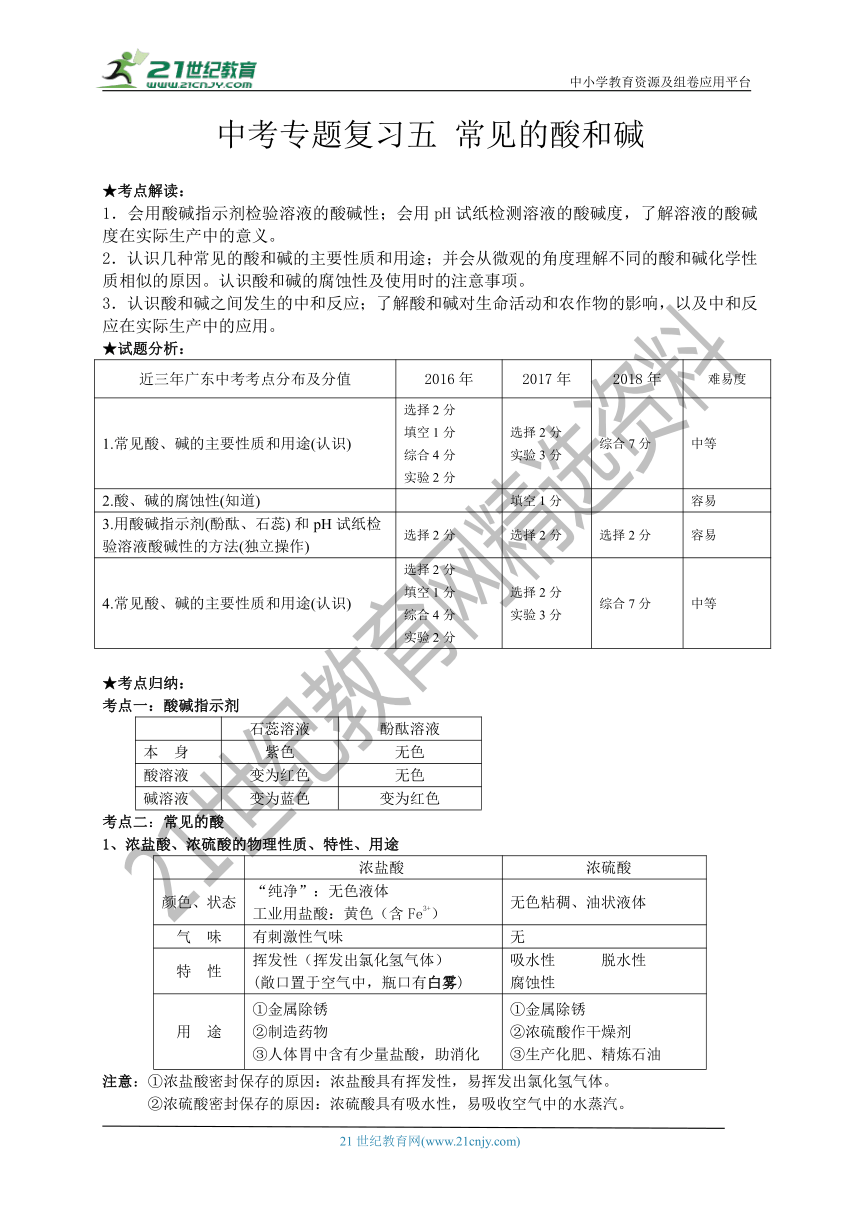
中考专题复习五 常见的酸和碱 ★考点解读: 1.会用酸碱指示剂检验溶液的酸碱性;会用pH试纸检测溶液的酸碱度,了解溶液的酸碱度在实际生产中的意义。 2.认识几种常见的酸和碱的主要性质和用途;并会从微观的角度理解不同的酸和碱化学性质相似的原因。认识酸和碱的腐蚀性及使用时的注意事项。 3.认识酸和碱之间发生的中和反应;了解酸和碱对生命活动和农作物的影响,以及中和反应在实际生产中的应用。 ★试题分析: 近三年广东中考考点分布及分值 2016年 2017年 2018年 难易度 1.常见酸、碱的主要性质和用途(认识) 选择?2?分 填空?1?分 综合?4?分 实验?2?分 选择?2?分 实验?3?分 综合?7?分 中等 2.酸、碱的腐蚀性(知道) 填空?1?分 容易 3.用酸碱指示剂(酚酞、石蕊)?和?pH?试纸检验溶液酸碱性的方法(独立操作) 选择?2?分 选择?2?分 选择?2?分 容易 4.常见酸、碱的主要性质和用途(认识) 选择?2?分 填空?1?分 综合?4?分 实验?2?分 选择?2?分 实验?3?分 综合?7?分 中等 ★考点归纳: 考点一:酸碱指示剂 石蕊溶液 酚酞溶液 本 身 紫色 无色 酸溶液 变为红色 无色 碱溶液 变为蓝色 变为红色 考点二:常见的酸 1、浓盐酸、浓硫酸的物理性质、特性、用途 浓盐酸 浓硫酸 颜色、状态 “纯净”:无色液体 工业用盐酸:黄色(含Fe3+) 无色粘稠、油状液体 气 味 有刺激性气味 无 特 性 挥发性(挥发出氯化氢气体) (敞口置于空气中,瓶口有白雾) 吸水性 脱水性 腐蚀性 用 途 ①金属除锈 ②制造药物 ③人体胃中含有少量盐酸,助消化 ①金属除锈 ②浓硫酸作干燥剂 ③生产化肥、精炼石油 注意:①浓盐酸密封保存的原因:浓盐酸具有挥发性,易挥发出氯化氢气体。 ②浓硫酸密封保存的原因:浓硫酸具有吸水性,易吸收空气中的水蒸汽。 ③浓盐酸敞口放置在空气中一段时间后,溶质、溶液质量减少,溶剂质量不变,溶质质量分数减少。 ④浓硫酸敞口放置在空气中一段时间后,溶质质量不变,溶剂、溶液质量增加,溶质质量分数减少。 ⑤稀释浓硫酸时:应把浓硫酸沿烧杯壁慢慢注入水里,并不断搅动使产生的热量迅速扩散,切不可把水直接倒入浓硫酸中。 ⑥如果不慎将浓硫酸沾到皮肤或衣服上,应先用布拭去,再用水冲洗,最后涂上3%—5%的碳酸氢钠溶液。 ⑦稀盐酸不具有挥发性;稀硫酸不具有吸水性 2、酸的化学性质: (1)酸溶液具有相似化学性质的原因是不同的酸溶液里都含有相同的氢离子。 (2)酸与酸碱指示剂反应时,显色的物质是指示剂,而不是酸溶液。 (3)根据活泼金属与酸反应的快慢和盐酸的挥发性,可以推断出实验室里制取氢气时,应该选用锌和稀硫酸反应为好。 (4)根据铁锈(主要成分是氧化铁)能与盐酸、硫酸反应,不难推出可以用稀盐酸或稀硫酸来除铁锈;反过来亦然成立。 (5)在做中和反应的实验时,一般都要用指示剂酚酞试液来帮助判断反应是否完成。也就是,事先在碱溶液中滴入几滴酚酞试液(使溶液成红色),然后再慢慢地向其中滴入稀酸溶液,边滴边振荡(或搅拌溶液),直到溶液颜色恰好变成无色。 3、三种离子的检验 试 剂 现 象 Cl- AgNO3 及HNO3 产生白色沉淀 SO42- ①Ba(NO3)2及HNO3②HNO3及BaCl2 产生白色沉淀 CO32- HCl 及石灰水 有无色气泡产生,石灰水变浑浊 考点三:常见的碱 1、氢氧化钠、氢氧化钙的物理性质、用途 氢氧化钠 氢氧化钙 颜色、状态 白色固体,极易溶于水(溶解放热)易潮解 白色粉末,微溶于水 俗 名 烧碱、火碱、苛性钠(具有强腐蚀性) 熟石灰、消石灰 制 法 Ca(OH)2+Na2CO3== CaCO3↓+2NaOH CaO +H2O== Ca(OH)2 用 途 ①氢氧化钠固体作干燥剂 ②化工原料:制肥皂、造纸 ③去除油污:炉具清洁剂中含氢氧化钠 ①工业:制漂白粉 ②农业:改良酸性土壤、配波尔多液 ?③建筑: 注意:①氢氧化钠的潮解属于 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

