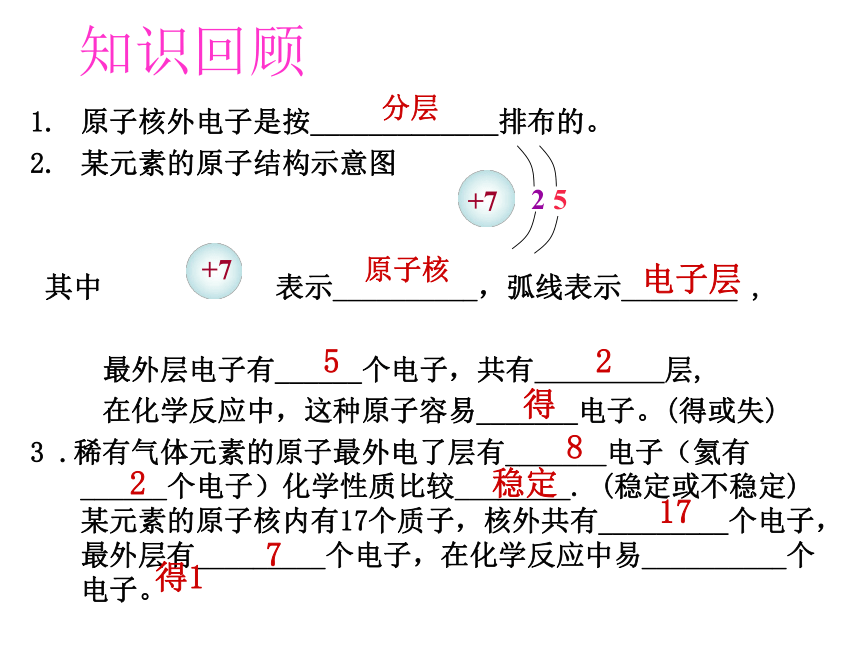
课件27张PPT。知识回顾原子核外电子是按_____排布的。 某元素的原子结构示意图 其中 表示_____,弧线表示_____ , 最外层电子有_____个电子,共有 层, 在化学反应中,这种原子容易_____电子。(得或失) 3 .稀有气体元素的原子最外电了层有_____电子(氦有_____个电子)化学性质比较_____. (稳定或不稳定)某元素的原子核内有17个质子,核外共有_____个电子,最外层有_____个电子,在化学反应中易_____个电子。 +7 得 2 5 电子层原子核 稳定 2 8 分层 得1 7 17 决定了元素的化学性质各元素原子最外电子数目的特点: 易失 电子稳定易得 电子 8 (He为2个)一 般﹤ 4一般≥4, ﹤8相对稳定结构不稳定 结构不稳定 结构稳定活泼活泼原子最外层电子数�离子的形成第三单元 物质构成的奥秘钠原子(Na)钠离子( Na+ )氯原子(Cl )氯离子( Cl- )带正电带负电 钠与氯气的反应钠原子(Na)氯原子(Cl )钠离子( Na+ )阳离子氯离子( Cl- )阴离子食盐(氯化钠)显不显电性?为什么?阴阳离子由于静电作用,可结合成不显电性的化合物 一、离子的形成原子阴离子( - )阳离子( + )1、概念:带电的原子或原子团,如S2-、SO42-。 离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。2、离子的表示方法:离子结构示意图Na+离子符号Cl-在元素符号的右上角标出所带的电荷数,数值在前符号在后,1可以省略不写。 如:Na+ Mg2+ Cl- O2- 离子———带电荷的原子或原子团Na+ Ca2+ Mg2+ Al3+ H+ NH4+ Cl- O2- F- OH- SO42- NO3- CO32-常见的离子请思考如下问题Na变成Na+有哪些变化?Cl变成Cl-?1、最外层电子数一定 。 2、核电荷数或质子数一定 。 3、电子层 。 4、元素种类 。 5、化学性质 。改变不变 可能改变不变改变最外层均为相对稳定结构, 且质子数与电子数 。 3、离子的特点当质子数大于电子数时,为 离子 当质子数小于电子数时,为 离子阳阴不相等 4、离子符号的意义2Mg2+表示2个镁离子表示每个镁离子带2个单位的正电荷S2-3S2-练习:说出下符号的意义表示3个硫离子练习:下列离子符号的意义Na+ Mg2+ 3Al3+ O2- F- 3Ca2+ 原子中: 核电荷数 质子数 核外电子数 阳离子: 核电荷数 质子数 核外电子数 阴离子: 核电荷数 质子数 核外电子数====><SNaCl-O2-NeNa+讨论与思考: 原子与离子的区别与联系联系:原子阳离子原子是化学变化中的最小微粒而离子是带电的原子或原子团原子不带电而离子带电原子是不稳定结构而离子是稳定结构阴离子 小结:物质与构成粒子间的关系世界上千千万万的物质都是由分子,原子和离子 构成的。具有相 同核电 荷数的 一类原 子元素 原 子 分子离子单质化合物物质稀有气体、 金属等氧气、水、 氢气等氯化钠等聚集构成构成得到或 失去电子构成分解同种元 素组成不同种 元素组成小结: 原子分子离子金属、稀有气体、碳、硅、硫、磷氧气、氮气、氢气、水、二氧化碳像氯化钠、高锰酸钾等这样由金属与非金属 形成的化合物二、离子的形成小结1.离子的概念:带电荷的原子(或原子团)2.阴离子:带负电荷的原子叫做阴离子。 如: O2- 、S2-、 F- 、Cl-、 阳离子:带正电荷的原子叫做阳离子。 如: H+ 、Na+、 Mg2+ 、Al3+3.离子符号的书写:先写元素或原子团,再把带电量标到右上角(数前号后1不写)例:氢离子 硅离子 碳酸根离子 3个硫酸根离子4.离子所带电荷数由该元素原子的最外层电子数决定。小 结 本 节 课 知 识学完本课题你应该知道 1、原子核外是分层排布的。 2、原子的结构可以用原子结构示意图表示。 3、原子的核外电子排布,特别是最外层的电子数目,与元素的化学性质有着密切关系。 4、构成物质的粒子除原子、分子之外,还有离子。离子是由于原子得失电子形成的。1. 在化学反应里, ... ...
~~ 您好,已阅读到文档的结尾了 ~~