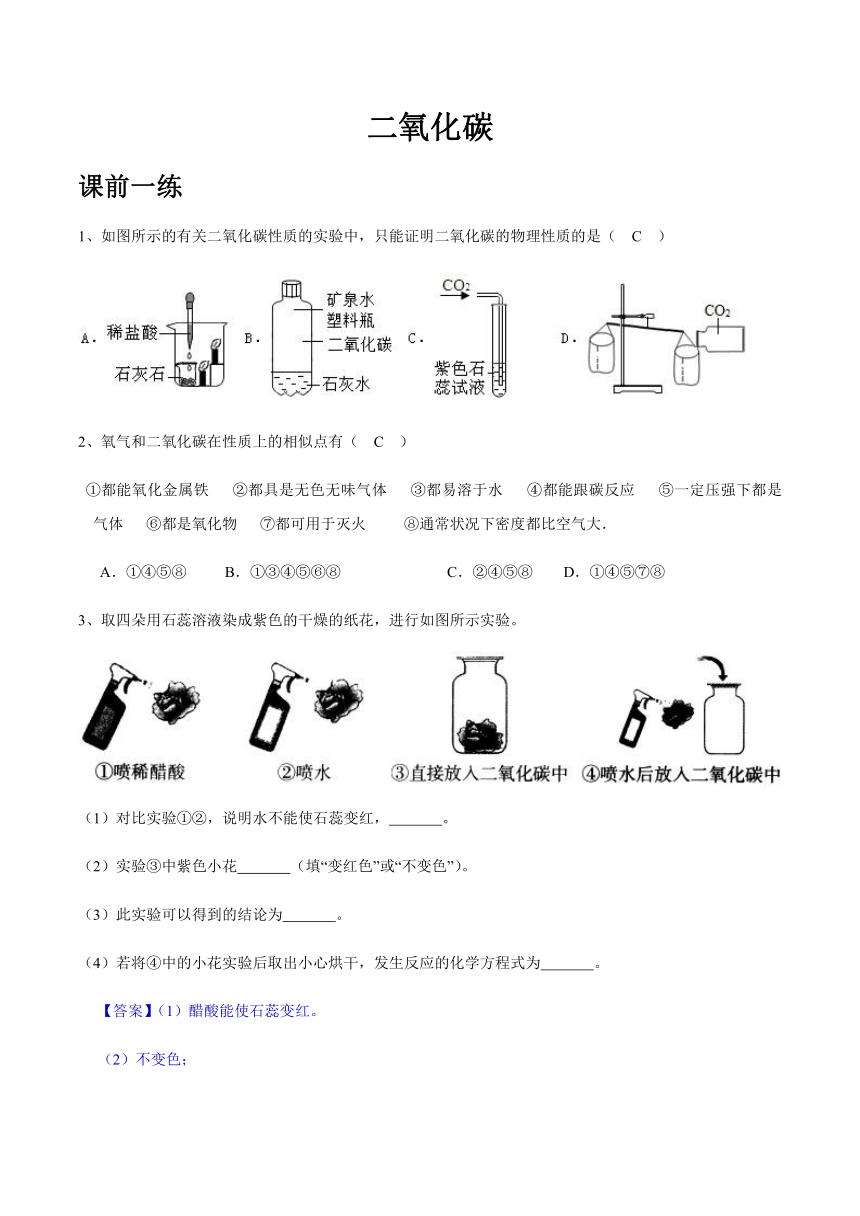
二氧化碳 课前一练 1、如图所示的有关二氧化碳性质的实验中,只能证明二氧化碳的物理性质的是( C ) 2、氧气和二氧化碳在性质上的相似点有( C ) ①都能氧化金属铁 ②都具是无色无味气体 ③都易溶于水 ④都能跟碳反应 ⑤一定压强下都是气体 ⑥都是氧化物 ⑦都可用于灭火 ⑧通常状况下密度都比空气大. A.①④⑤⑧ B.①③④⑤⑥⑧ C.②④⑤⑧ D.①④⑤⑦⑧ 3、取四朵用石蕊溶液染成紫色的干燥的纸花,进行如图所示实验。 (1)对比实验①②,说明水不能使石蕊变红, 。 (2)实验③中紫色小花 (填“变红色”或“不变色”)。 (3)此实验可以得到的结论为 。 (4)若将④中的小花实验后取出小心烘干,发生反应的化学方程式为 。 【答案】(1)醋酸能使石蕊变红。 (2)不变色; (3)二氧化碳和水反应,生成酸性物质。 (4)H2CO3=CO2↑+H2O。 要点导航 一、自然界中的二氧化碳 1、二氧化碳在空气中含量不多,约占 0.03%。 2、二氧化碳是由大量二氧化碳分子 (CO2) 聚集而成,每个二氧化碳分子由一个碳原子和两个氧原子构成,其分子结构模型如图所示: 3、CO2本身没有毒性,但当空气中的 CO2超过正常含量时,会对人体产生有害的影响。 二、二氧化碳的性质 1、物理性质:二氧化碳在通常状态下,无色无味,能溶于水,密度比空气大;固体(干冰) 2、化学性质: (1)不能燃烧,不支持燃烧,也不能供呼吸 (2)二氧化碳溶解在水里时,跟水发生化学反应生成碳酸 (H2CO3)。碳酸呈酸性,能使紫色石蕊试液变成红色。 CO2 + H2O=H2CO3 H2CO3=H2O+CO2↑ 碳酸很不稳定,很容易分解。当加热时,碳酸会分解,逸出二氧化碳,剩下中性的水,因此,红色的石蕊又变成了紫色。 (3)当向澄清石灰水[Ca(OH)2水溶液]里通入二氧化碳时,会生成白色 的碳酸钙(CaCO3 )沉淀,使石灰水变浑浊。这一反应常用来检验二氧化碳。 CO2 + Ca(OH)2=CaCO3↓+ H2O (4)与Mg反应:2Mg+CO22MgO+C 现象:Mg条在CO2中剧烈燃烧,放出白光和大量热,生成黑色固体和白色固体。 (5)与C反应:CO2 + C2CO CO2 与C 在高温条件下,生成无色、无臭、无味的气体CO ,密度比空气小,具有毒性,一氧化碳进入人体之后会和血液中的血红蛋白结合,产生碳氧血红蛋白,进而使血红蛋白不能与氧气结合,从而引起机体组织出现缺氧,导致人体窒息死亡。 二氧化碳的制备 1、实验室制备 (1)制备原理:CaCO3+2HCl=CaCl2+H2O+CO2↑ (2)制取装置: (3)实验仪器:石灰石(或大理石)、稀盐酸、澄清石灰水、紫色石蕊试液、蒸馏水、锥形瓶、烧杯、双孔橡皮塞、橡皮管、玻璃导管、集气瓶、玻璃片、蜡烛、木条、火柴、铁皮架。 (4)操作步骤: ①如图组装好制取二氧化碳的简易装置,检查装置的气密性。 ②在锥形瓶中加入几小块大理石,塞紧带有长颈漏斗和导管的橡皮塞。 ③把气体导管插入集气瓶中,导管口应处在接近集气瓶的瓶底处。 ④通过长颈漏斗加入适量的稀盐酸,锥形瓶中立刻有气体产生。 ⑤片刻后,把燃着的火柴放到集气瓶口的上方,如果火柴很快熄灭说明集气瓶中已经收集满二氧化碳气体,盖好毛玻璃片,将集气瓶口向上放在桌子上备用。 (5)检验:将气体通入澄清石灰水,石灰水变浑浊。 (6)验满:将燃着木条 放在集气瓶口,若木条熄灭,则集满。 (7)思考讨论: ①装置缺陷—盐酸易挥发,污染环境;反应不能控制,不能随用随停。 ②改进装置: (8)注意事项: ①制备二氧化碳的盐酸不宜太浓,否则从盐酸里会挥发出氯化氢气体,使制得的二氧化碳不纯,有时还会影响实验的结果。 ②不宜使用硫酸和石灰石来制取二氧化碳,因为硫酸与碳酸钙反应后生成溶解性较小的硫酸钙,会覆盖在石灰石表面从而阻止反应的继续进行。 ③如果使用长颈漏斗,最 ... ...
~~ 您好,已阅读到文档的结尾了 ~~