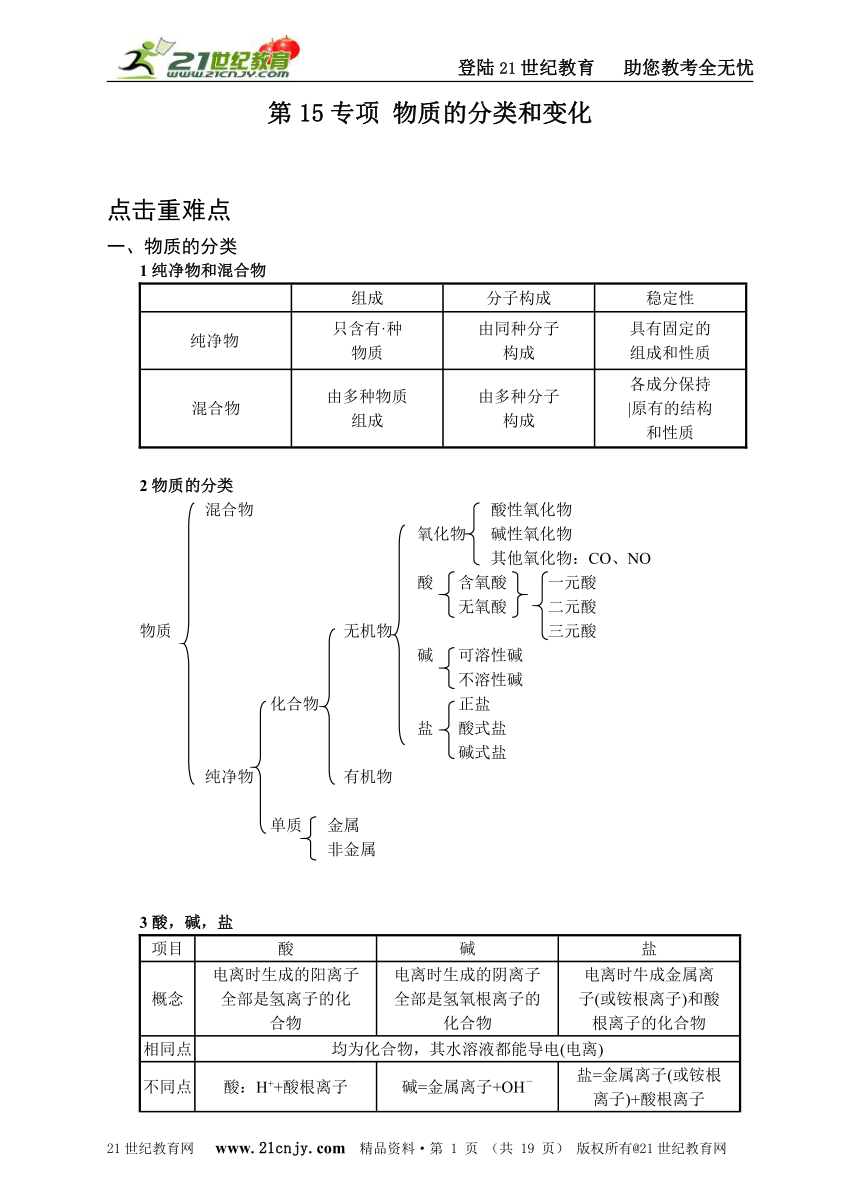
登陆21世纪教育 助您教考全无忧 第15专项 物质的分类和变化 点击重难点 一、物质的分类 1纯净物和混合物 组成 分子构成 稳定性 纯净物 只含有·种物质 由同种分子构成 具有固定的组成和性质 混合物 由多种物质组成 由多种分子构成 各成分保持|原有的结构和性质 2物质的分类 混合物 酸性氧化物 氧化物 碱性氧化物 其他氧化物:CO、NO 酸 含氧酸 一元酸 无氧酸 二元酸 物质 无机物 三元酸 碱 可溶性碱 不溶性碱 化合物 正盐 盐 酸式盐 碱式盐 纯净物 有机物 单质 金属 非金属 3酸,碱,盐 项目 酸 碱 盐 概念 电离时生成的阳离子全部是氢离子的化合物 电离时生成的阴离子全部是氢氧根离子的化合物 电离时牛成金属离子(或铵根离子)和酸根离子的化合物 相同点 均为化合物,其水溶液都能导电(电离) 不同点 酸:H++酸根离子 碱=金属离子+OH- 盐=金属离子(或铵根离子)+酸根离子 组成特点 一定含氧元素 定含氢、氧两种元素 一定含有非金属元素 二、物质的变化 1物质的变化 物理变化 特征:没有其他物质生成 本质:分子本身不改变 物质的变化 特征:有其他物质生成 本质:分子破裂成原子,原子重新组合成新物质的分子 表示方法:化学方程式 内容:(略) 适用范围:一切化学反应 理论依据:质 质量守恒原则:化学变化的实质 化学变化 量守恒定律 书写、配平化学方程式 (化学反应) 应用 根据化学方程式计算 有关物质组成的判定 解释一些简单的现象 氧化反应:(得氧) 还原反应:(失氧) 反应类型 化合反应:多变一 分解反应:一变多 置换反应:单1+化1→单2+化2 复分解反应:化1+化2→化3+化4 2从质量守恒的角度认识化学反应 反应物和生成物的总质量不变 宏观 元素种类不变 六个不变 同种元素的质量不变 原子种类不变 微观 原子数目不变 质量守恒的微观本质 化学反应的过程 原子的质量不变 两个一定改变 宏观:物质的种类一定改变 微观:分子种类一定改变 两个可能改变 分子总数可能改变 元素化合价可能改变 3 氧化反应、还原反应中一些概念之间的关系 4 化学反应的类型 化学反应的基本类型比较。 反应类型 概念 特征 举例 化合反应 由两种或两种以上的物质生成另一种物质的反应。 A+B→AB 多变一 S+O2SO2 分解反应 一种物质生成两种或两种以上其他物质的反应。 AB→A+B 一变多 2H2O2H2↑+O2↑ 置换反应 一种单质跟一种化合物反应生成另一种单质和另一种化合物 A+BC→B+AC 一换一 2HCl+Zn═══ZnCl2+H2↑ 复分解反应 两种化合物相互交换成分,生成两种新化合物的反应。 AB+CD→AD+BC成分相交换 H2SO4+2NaOH═══Na2SO4+2H2O 5 四种基本反应类型与氧化还原反应、中和反应 (1)氧化还原反应交义于分解反应、化合反应和置换反应中,不属于哪种摹本类型。如 分解反应中有氧化还原反应,也有非氧化还原反应;[例如:2KClO3═══KCl+3O2↑(氧化 还原反应);H2CO3═══H2O+CO2↑(非氧化还原反应)]同样化合反应中有氧化还原反应,也有非氧化还原反应;置换反应都属于氧化还原反应(到高中学习);复分解反应都属于非氧化还原反应。 (2)中和反应是酸和碱作用生成盐和水的反应,是复分解反应的特例。 评析中考点 考点1 某物质经鉴定只含有一种元素,下列说法正确的是( ) A肯定是纯净物 B可能是混合物 C肯定是某一种单质 D一定是一种稀有气体 ※思路点拨※ 混合物由多种物质组成,由于组成每种物质的元素可能备不相同也可能相同,所以混合物中的元素可能是多种也可能是一种。例如:空气是混合物,其中含有O、H、N等多种元素;O2和O3的混合物就只有一种元素。可见,同种元素组成的物质不一定是纯净物,也不一定是单质。 ※解答辨析※ B ※考点点评※ 物质类别的判断要特别注意类别的前提,如单质、化合物首先是纯净物;氧化物、酸、碱、盐首先 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

