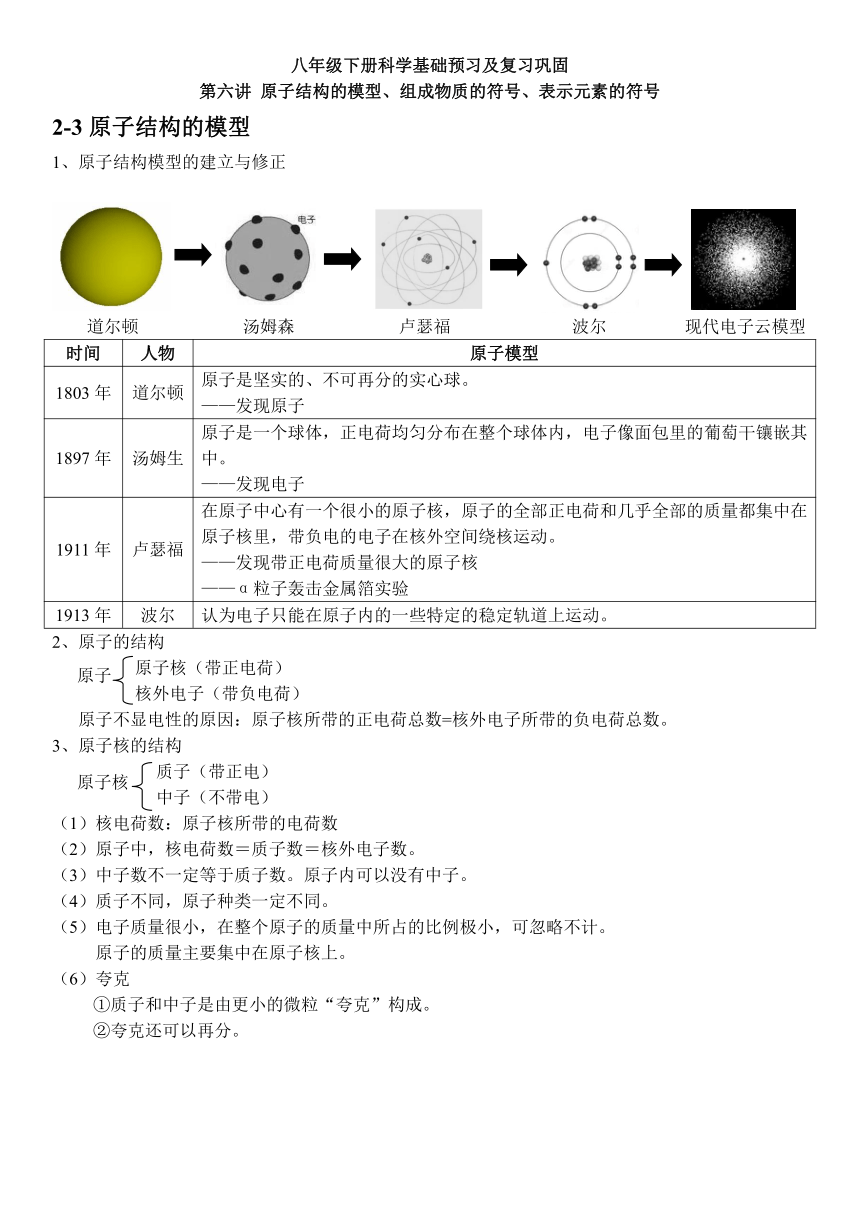
八年级下册科学基础预习及复习巩固 第六讲 原子结构的模型、组成物质的符号、表示元素的符号 2-3原子结构的模型 原子结构模型的建立与修正 56216557810500521525547180500 430720578105003856355471805002846705781050023958554210050014370052730500108140538290500 道尔顿 汤姆森 卢瑟福 波尔 现代电子云模型 时间 人物 原子模型 1803年 道尔顿 原子是坚实的、不可再分的实心球。 ———发现原子 1897年 汤姆生 原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。 ———发现电子 1911年 卢瑟福 在原子中心有一个很小的原子核,原子的全部正电荷和几乎全部的质量都集中在原子核里,带负电的电子在核外空间绕核运动。 ———发现带正电荷质量很大的原子核 ———α粒子轰击金属箔实验 1913年 波尔 认为电子只能在原子内的一些特定的稳定轨道上运动。 原子的结构 -1911351714500 12700023495原子 00原子 原子核(带正电荷) 核外电子(带负电荷) 原子不显电性的原因:原子核所带的正电荷总数=核外电子所带的负电荷总数。 3、原子核的结构 706120393700012700064770原子核 00原子核 质子(带正电) 中子(不带电) (1)核电荷数:原子核所带的电荷数 (2)原子中,核电荷数=质子数=核外电子数。 (3)中子数不一定等于质子数。原子内可以没有中子。 (4)质子不同,原子种类一定不同。 (5)电子质量很小,在整个原子的质量中所占的比例极小,可忽略不计。 原子的质量主要集中在原子核上。 (6)夸克 ①质子和中子是由更小的微粒“夸克”构成。 ②夸克还可以再分。 2-4组成物质的符号 1、离子 (1)离子:带电的原子或原子团(离子的组成元素不止一种)。 (2)离子和分子、原子一样也是构成物质的基本粒子。 (3)阳离子:带正电的原子或原子团。 阴离子:带负电的原子或原子团。 2、同位素 (1)元素:具有相同的核电荷数(即质子数)的同一类原子的总称。 ①元素表示物质的宏观组成。 ②只讲种类,不讲个数。 (2)同位素 定义:原子中原子核内质子数相同、中子数不相同的同类原子互为同位素原子。 氢的3种同位素 3、元素的种类 (1)目前人类已知的元素有110多种,包括人造元素。 (2)元素分类:金属元素、非金属元素和稀有气体。 ①金属元素中文名带“钅”字旁(汞,也叫水银,常温下是液态)。 ②非金属元素中文名中带“石”字旁的表示常温下它的单质为固态,带“气”字头的为气态,带“氵”字旁为液态。 ③稀有气体通常状况下为气体,名称都是“气”字头,它们是由原子直接构成的[如氦气(He)]。 (3)由多种物质组成叫混合物。由一种物质组成叫纯净物。 纯净物分为单质和化合物 单质:由同种元素组成的纯净物。举例:氧气、金属铁等。 化合物:由不同种元素组成的纯净物。举例:二氧化碳、水等。 4、元素的分布 ①地壳中元素含量记忆规律:氧硅铝铁钙、钠钾镁氢钛(养龟铝铁盖,哪家没青菜)。 ②其中含量最高的是氧(O),其次是硅(Si),然后是铝(Al)。金属元素中含量最高的是铝(Al),其次是铁(Fe)。 47986952297430人体 00人体 7372352297430地壳 00地壳 393001510287000 ③在人体中含量最高的是氧元素,其次是碳(C)、氢(H)。 ④海水中含量多到少:氧(O)、氢(H)、氯(Cl)、钠(Na)。 ⑤有机物(葡萄糖、蛋白质、脂肪等)主要由碳(C)、氢(H)、氧(O)组成。 5、元素的作用 (1)放射性元素的作用:可以检查和治疗一?些疾病,如"放疗“杀死肿瘤细胞,也可以用于灭菌和消毒,如辐照食品。 (2)人体中元素的作用 ①构成各种组织,如钙和磷构成骨骼、牙齿等,碳、氢、氧、氮硫构成血液、毛发、肌肉等。 ②运载作用,如含铁的血红蛋白对氧气和二氧化碳的运载作用。 ... ...
~~ 您好,已阅读到文档的结尾了 ~~