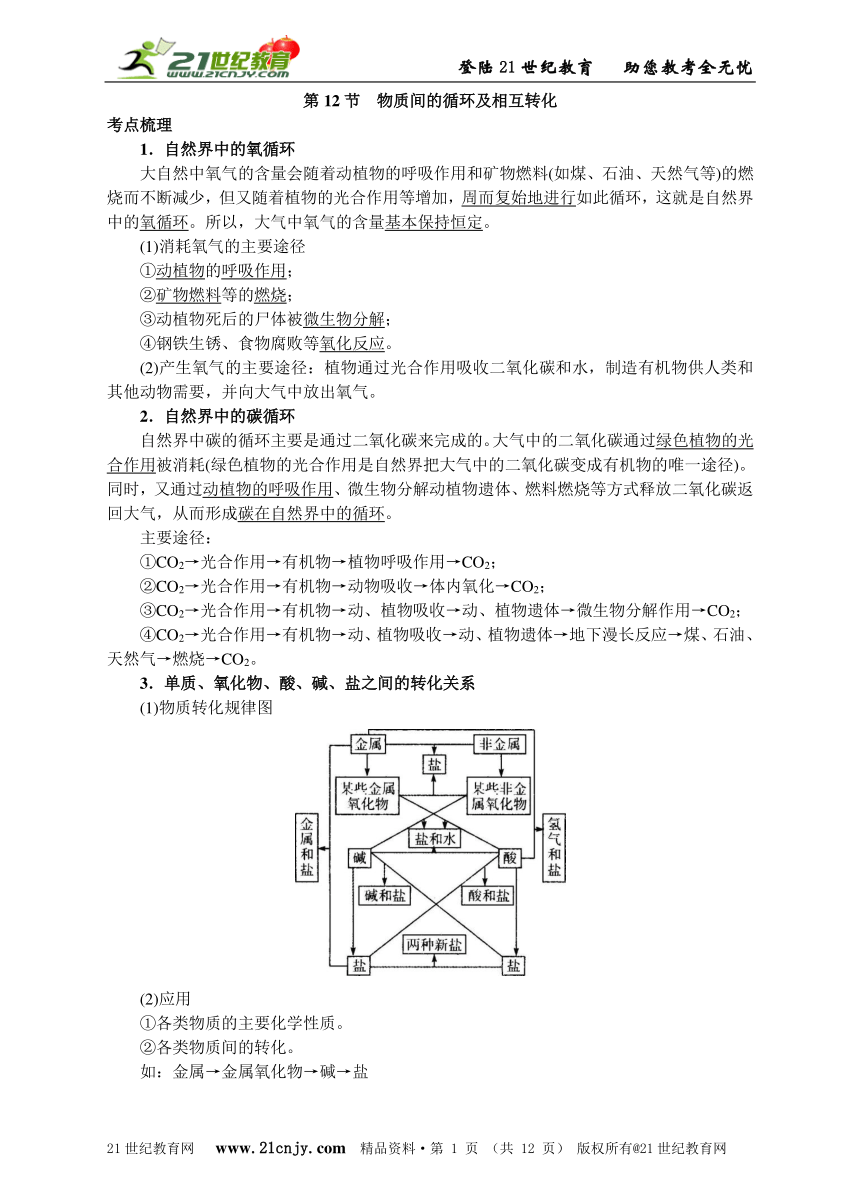
第12节 物质间的循环及相互转化 考点梳理 1.自然界中的氧循环 大自然中氧气的含量会随着动植物的呼吸作用和矿物燃料(如煤、石油、天然气等)的燃烧而不断减少,但又随着植物的光合作用等增加,周而复始地进行如此循环,这就是自然界中的氧循环。所以,大气中氧气的含量基本保持恒定。 (1)消耗氧气的主要途径 ①动植物的呼吸作用; ②矿物燃料等的燃烧; ③动植物死后的尸体被微生物分解; ④钢铁生锈、食物腐败等氧化反应。 (2)产生氧气的主要途径:植物通过光合作用吸收二氧化碳和水,制造有机物供人类和其他动物需要,并向大气中放出氧气。 2.自然界中的碳循环 自然界中碳的循环主要是通过二氧化碳来完成的。大气中的二氧化碳通过绿色植物的光合作用被消耗(绿色植物的光合作用是自然界把大气中的二氧化碳变成有机物的唯一途径)。同时,又通过动植物的呼吸作用、微生物分解动植物遗体、燃料燃烧等方式释放二氧化碳返回大气,从而形成碳在自然界中的循环。 主要途径: ①CO2→光合作用→有机物→植物呼吸作用→CO2; ②CO2→光合作用→有机物→动物吸收→体内氧化→CO2; ③CO2→光合作用→有机物→动、植物吸收→动、植物遗体→微生物分解作用→CO2; ④CO2→光合作用→有机物→动、植物吸收→动、植物遗体→地下漫长反应→煤、石油、天然气→燃烧→CO2。 3.单质、氧化物、酸、碱、盐之间的转化关系 (1)物质转化规律图 (2)应用 ①各类物质的主要化学性质。 ②各类物质间的转化。 如:金属→金属氧化物→碱→盐 例:Ca CaO Ca(OH)2 CaCO3 如:非金属→非金属氧化物→酸→盐 例:S SO2H2SO3Na2CO3 4.根据单质、氧化物、酸、碱、盐之间的转化规律设计物质制备的方案 例:盐的制备思路有: (1)金属+非金属→盐 (2)金属氧化物+非金属氧化物→盐 (3)金属氧化物+酸→盐+水 (4)非金属氧化物+碱→盐+水 (5)酸+碱→盐+水 (6)酸十盐→新酸+新盐 (7)碱+盐→新碱+新盐 (8)盐+盐→两种新盐 (9)金属+酸→盐+氢气 (10)金属+盐→新金属+新盐 【思考】 你知道上述各反应发生的条件吗? 5.一些简单物质的鉴别 常见物质 检验方法(试剂) 主要现象 氧气 带火星的木条 木条复燃 二氧化碳 澄清石灰水 澄清石灰水变浑浊 氢气 点燃,并在上方罩一只干冷 的小烧杯 燃烧,产生淡蓝色火焰,烧杯内有小液滴(水雾)出现 酸 紫色石蕊试液 紫色石蕊试液变红色 碱 无色酚酞、试液 无色酚酞试液变红色 盐酸盐 硝酸银、稀硝酸 产生不溶于稀硝酸的白色沉淀 硫酸盐 氯化钡、稀硝酸 产生不溶于稀硝酸的白色沉淀 碳酸盐 稀盐酸 产生使澄清石灰水变浑浊的气体 铵盐 碱、加热 产生一种有刺激性气味的气体,该气体能使红色石蕊试纸变蓝 【思考】 回忆一下,对于一些常见物质的颜色你知道多少? 6.离子的鉴别 (1)cl—:滴加AgNO3溶液,产生白色沉淀,加稀HNO3沉淀不溶解。 (2)SO:滴加BaCl2或Ba(NO3)2溶液,产生白色沉淀,加稀HNO3沉淀不溶解。 (3)CO:滴加稀盐酸,产生气泡,该气体能使澄清石灰水变浑浊。 (4)Cu2+:蓝色溶液,遇碱溶液产生蓝色絮状沉淀。 (5)Fe3+:黄色溶液,遇碱溶液产生红褐色絮状沉淀。 高频考点及真题演练 高频考点一 自然界中氧和碳的循环 考题一 (2011.杭州)鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,加入某种药品,使容器内满足下列条件才能保持鱼苗的存活:充足的氧气、及时除去鱼苗呼出的CO2、水的pH调节在8左右。碱性不能太强,现在以下四种物质供选择:双氧水、过氧化钙(CaO2)、过氧化钠(Na2O2)、氯酸钾。它们的有关化学性质如下: (1)2H2O2=2H2O+O2↑ (2)2Na2O2+2H2O=4NaOH+O2↑ (3)2Na2O2+2CO2=2Na2CO3+O2 (4)2CaO2+2H2O=2Ca(OH)2+O2↑ (5)2CaO2+2CO2=2CaCO3+O2 (6)KClO3不与H2O、CO2反应 在鱼苗长途运输中你认为最适合加入的 ... ...
~~ 您好,已阅读到文档的结尾了 ~~