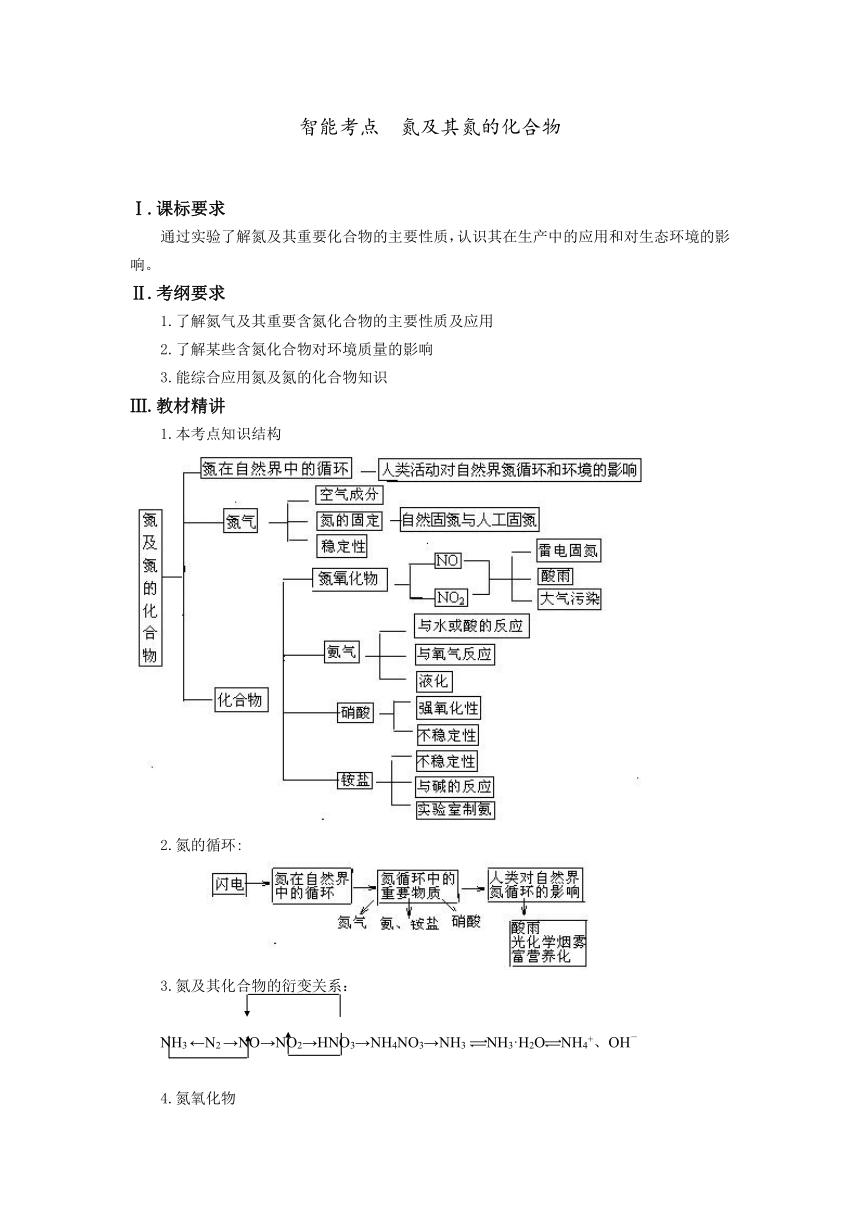
智能考点 氮及其氮的化合物 Ⅰ.课标要求 通过实验了解氮及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。 Ⅱ.考纲要求 1.了解氮气及其重要含氮化合物的主要性质及应用 2.了解某些含氮化合物对环境质量的影响 3.能综合应用氮及氮的化合物知识 Ⅲ.教材精讲 1.本考点知识结构 2.氮的循环: 3.氮及其化合物的衍变关系: NH3 ←N2 →NO→NO2→HNO3→NH4NO3→NH3 NH3·H2ONH4+、OH- 4.氮氧化物 ①各种价态氮氧化物:(N2O)、(NO)、(N2O3)、(NO2、N2O4)、(N2O5),其中N2O3和N2O5分别是HNO2和HNO3的酸酐。气态的氮氧化物几乎都是剧毒性物质,在太阳辐射下还会与碳氢化物反应形成光化学烟雾。 ②NO和NO2性质比较 NO:一种无色气体,难溶于水,不成盐氧化物。常温下,极易被氧化为NO2:2NO+O2=2NO2 NO2:一种有刺激性气味的红棕色气体,溶于水后与水反应:3NO2+H2O==2HNO3+NO ③氮氧化物溶于水计算方法 涉及的可能相关化学反应方程式分别为:3NO2+H2O=2HNO3+NO、4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3、NO2+NO+O2+H2O=2HNO3。 NO与NO2混合气体溶于水:反应最后得到的气体是NO,其体积=V(NO)+1/3V(NO2) NO与O2的混合气体溶于水: 若V(NO)∶V(O2)=4∶3,则容器内无气体剩余,水可充满容器。 若V(NO)∶V(O2)>4∶3,则容器内剩余气体为过量的NO。 若V(NO)∶V(O2)<4∶3,则容器内剩余气体为过量的O2。 NO2与O2的混合气体溶于水: 若V(NO2)∶V(O2)=4∶1,则容器内无气体剩余,水可充满容器。 若V(NO2)∶V(O2)>4∶1,则NO2过量,容器内剩余气体为的NO,体积为过量的NO2的1/3。 若V(NO2)∶V(O2)<4∶1,则O2过量,容器内剩余气体为过量的O2。 NO2、NO与O2三种气体溶于水: 若V(NO2)∶V(NO)∶V(O2)=1∶1∶1,则容器内无气体剩余,水可充满容器。 若按1∶1∶1反应后,仍有某两种或一种气体多余可按前面思路进行判断。 5.硝酸的重要特性:强氧化性 ①浓、稀硝酸在与活泼或不活泼金属发生反应时,硝酸中被还原,一般不产生氢气。 ②浓、稀硝酸与活泼金属反应时,被还原,所得产物可以是(NO2)、(NO)、(N2O)、(N2)或(NH3),鉴于反应复杂,中学对活泼金属与浓、稀硝酸的反应不做要求。 ③浓、稀硝酸与金属铜的反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu- (NO3)2+2NO↑+4H2O。以上反应中,硝酸表现出氧化性同时还表现出酸性。其他不活泼金属类似于铜与浓、稀硝酸反应。注意:一定量的浓硝酸与足量的铜发生反应时,硝酸会由浓变稀,往往得到的是NO和NO2的混合气体。 ④浓硝酸与碳的反应:C+4HNO3(浓)CO 2↑+NO2↑+2H2O。硝酸只表现出氧化性。 ⑤在浓硝酸中滴加几滴石蕊试液、微热,先变红、后褪色,说明浓硝酸的酸性及氧化性。 ⑥冷的浓硝酸在常温下使铁、铝等活泼金属发生钝化(在其表面因氧化生成一层致密的氧化膜)。常温时,常把浓硝酸存放在铁质、铝质密闭容器里。但若加热,则会剧烈反应。 ⑦王水:浓硝酸与浓盐酸的混合物,其体积比为1:3。可溶解金、铂、钛等金属。 6.氨、液氨、氨水、铵之间的区别: 氨:无色有刺激性气味的气体,比空气轻。氨分子是一种呈三角锥形的极性分子,极易溶于水,易液化。液氨是氨气液化的产物,仍然是氨分子,属纯净物。 氨水是氨气的水溶液,是混合物:NH3+H2ONH3·H2ONH4++OH-。氨水中微粒有:NH3、H2O、NH3·H2O、NH4+、OH—、极少量的H+。氨水浓度越大,密度越小。 铵(NH4+)是带一个单位正电荷的离子,不能单独存在,只能在铵盐或氨水中与阴离子共存。凡是含NH4+的盐叫铵盐,铵盐易溶于水。铵盐不稳定,加热易分解。 氨与铵可相互转化:NH3 NH4+,NH4+与强碱反应放出NH3, 7.NH4+的检验方法: ①检验固态铵盐不必 ... ...
~~ 您好,已阅读到文档的结尾了 ~~