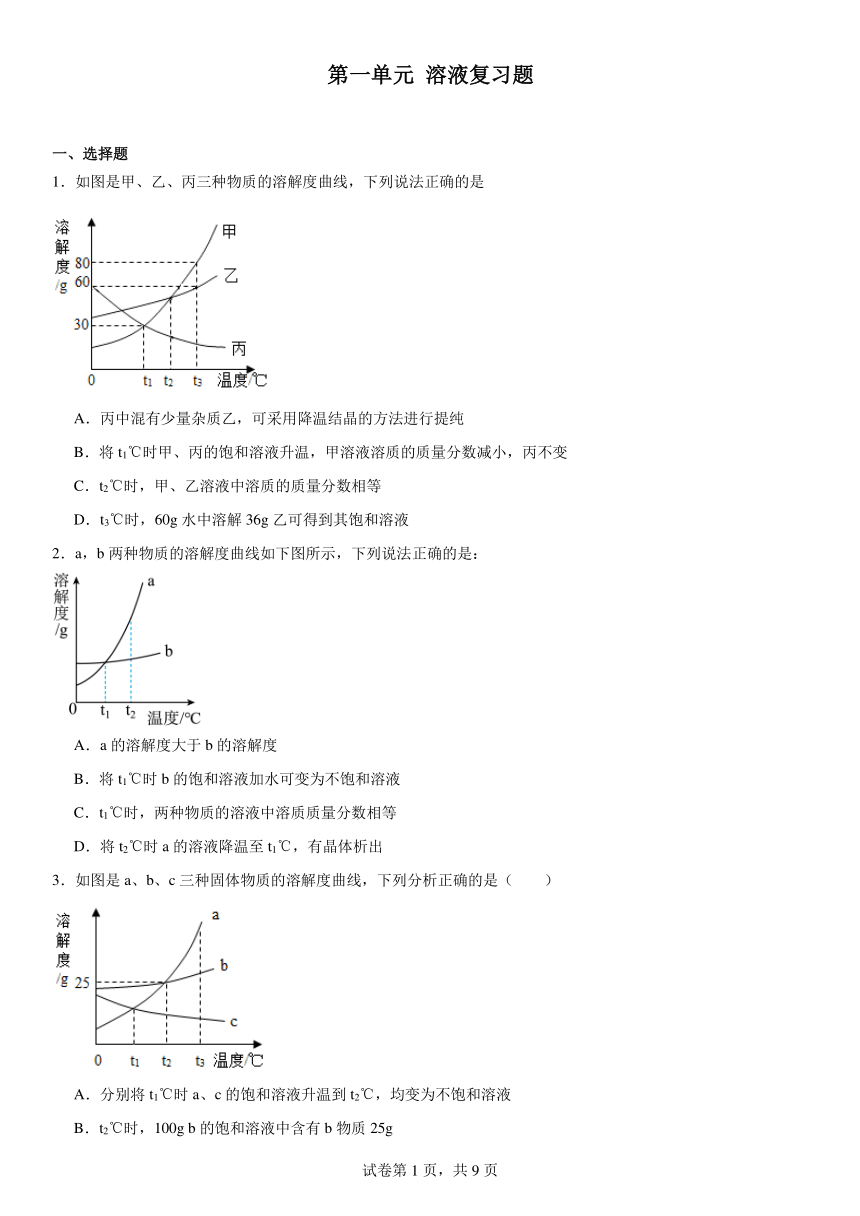
第一单元 溶液复习题 一、选择题 1.如图是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是 A.丙中混有少量杂质乙,可采用降温结晶的方法进行提纯 B.将t1℃时甲、丙的饱和溶液升温,甲溶液溶质的质量分数减小,丙不变 C.t2℃时,甲、乙溶液中溶质的质量分数相等 D.t3℃时,60g水中溶解36g乙可得到其饱和溶液 2.a,b两种物质的溶解度曲线如下图所示,下列说法正确的是: A.a的溶解度大于b的溶解度 B.将t1℃时b的饱和溶液加水可变为不饱和溶液 C.t1℃时,两种物质的溶液中溶质质量分数相等 D.将t2℃时a的溶液降温至t1℃,有晶体析出 3.如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( ) A.分别将t1℃时a、c的饱和溶液升温到t2℃,均变为不饱和溶液 B.t2℃时,100g b的饱和溶液中含有b物质25g C.t3℃时,分别将等质量的a、b溶液降温至t2℃,析出的固体质量关系是:a>b D.a中含有少量b时,可采用冷却a的热饱和溶液的方法提纯a 4.下列有关水或溶液的说法正确的是 A.用直流电电解水,发现负极与正极上得到的气体体积比约为2:1 B.自来水厂的净水过程中,加入明矾的作用是杀菌消毒 C.为了节约用水,可以用工业废水直接浇灌农田 D.均一、稳定的液体一定是溶液 5.如图为四种物质的溶解度曲线。则下列说法错误的是 A.当温度为10 ℃时,物质溶解度关系为①>③>②>④ B.若NH4H2PO4中混有少量NaCl杂质,可在较高温度配成饱和溶液,再降温结晶 C.在10 ℃时把NH4H2PO4和Ce2(SO4)3的饱和溶液升温到30 ℃ ,有晶体析出的是Ce2(SO4)3 D.22 ℃时(NH4)2HPO4饱和溶液的质量分数约为70% 6.现有一杯50℃的饱和硝酸钾溶液,欲改变其溶质质量分数,下列方法不可行的是 A.加入一定量的水 B.恒温蒸发部分水 C.降温到20℃ D.加50℃不饱和的硝酸钾溶液 7.下列实验方案设计不合理的是 选项 实验目的 实验操作 A 除去粗盐中的泥沙 溶解、过滤、蒸发、结晶 B 除去CO2中混有的CO 点燃 C 鉴别硝酸铵和氢氧化钠 分别加适量的水,用手触摸容器外壁 D 鉴别化肥KCl和NH4Cl 分别加入熟石灰、研磨、闻气味 A.A B.B C.C D.D 8.20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是 实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g) ① 10 2 12 ② 10 3 13 ③ 10 4 13.6 ④ 10 5 13.6 A.②中所得溶液是饱和溶液 B.20℃时NaCl的溶液度为40g C.①所得溶液的溶质质量分数为20% D.③④溶液的溶质质量分数相等 9.氢氧化钠和碳酸钠的溶解度如表所示。 溶剂 氢氧化钠 碳酸钠 20℃ 40℃ 20℃ 40℃ 水 109g 129g 21.8g 49g 酒精 17.3g 40g 难溶 难溶 下列有关分析和推理正确的是 A.二氧化碳通入饱和氢氧化钠酒精溶液,会变浑浊 B.20℃碳酸钠饱和水溶液溶质质量分数为21.8% C.40℃时,若将50gNaOH分别投入到100g水和100g酒精中,都能形成饱和溶液 D.40℃时用50g水配出NaOH的饱和溶液,再降温到20℃,析出NaOH晶体的质量为20g 10.水,滋润万物,与人们的生产生活息息相关,下列有关水的说法不正确的是( ) A.活性炭不能将硬水转化成软水 B.电解水得到的氢气和氧气质量比约为 2:1 C.水能溶解很多种物质,是一种最常用的溶剂 D.利用洗洁精的乳化作用可洗涤餐具上的油污 11.如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是 A.40℃时,100g甲的饱和溶液中含有50g甲 B.20℃时,甲、乙两种物质的溶解度均为30 C.甲、乙的饱和溶液从40℃降温到20℃,所得溶液中溶质质量分数相等 D.将20℃的甲、乙饱和溶液恒温蒸发等质量的水,二者析出晶体的质量不一定相等 12.已知硝酸钾在不同温度下的溶解度如表: 温度(℃) 20 30 40 50 60 70 80 溶解度(g/100g水) 32 45 64 85.5 110 138 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

