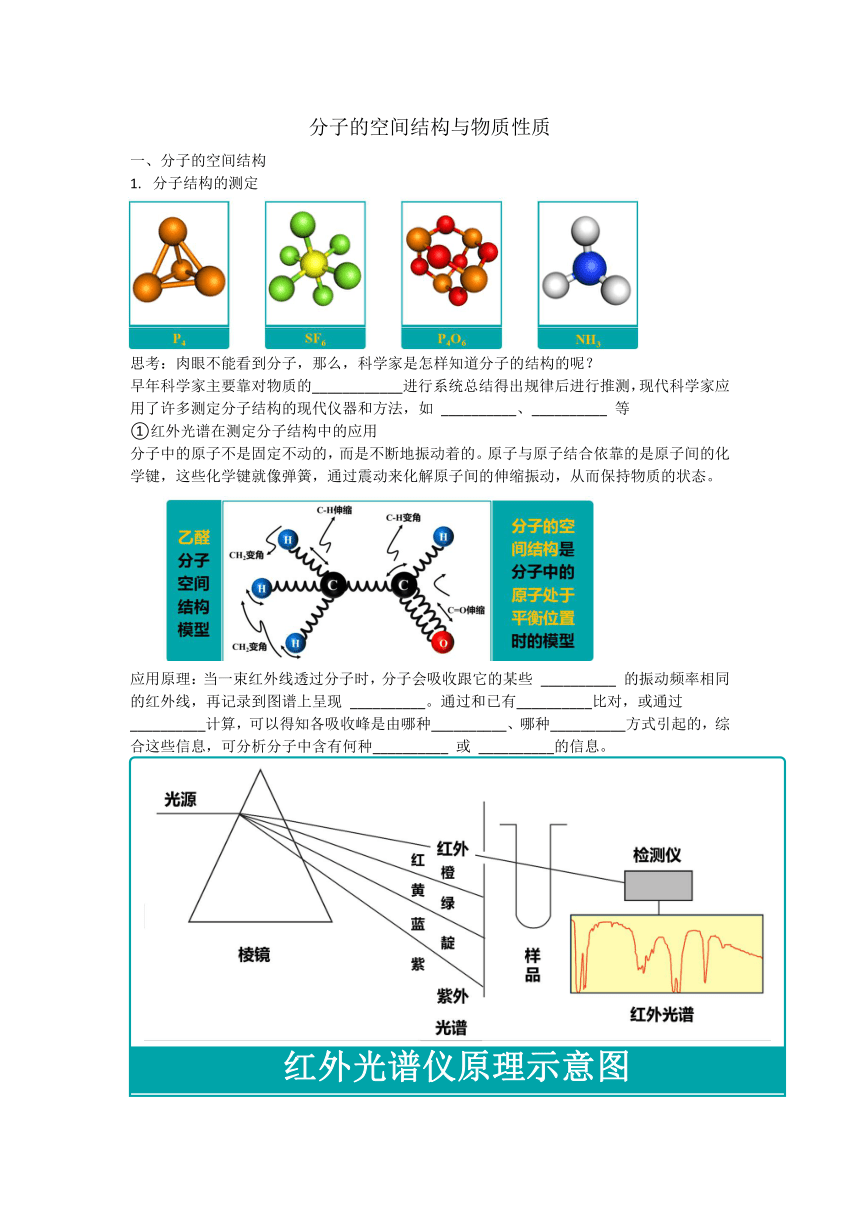
分子的空间结构与物质性质 分子的空间结构 分子结构的测定 思考:肉眼不能看到分子,那么,科学家是怎样知道分子的结构的呢? 早年科学家主要靠对物质的_____进行系统总结得出规律后进行推测,现代科学家应用了许多测定分子结构的现代仪器和方法,如 _____、_____ 等 ①红外光谱在测定分子结构中的应用 分子中的原子不是固定不动的,而是不断地振动着的。原子与原子结合依靠的是原子间的化学键,这些化学键就像弹簧,通过震动来化解原子间的伸缩振动,从而保持物质的状态。 应用原理:当一束红外线透过分子时,分子会吸收跟它的某些 _____ 的振动频率相同的红外线,再记录到图谱上呈现 _____。通过和已有_____比对,或通过_____计算,可以得知各吸收峰是由哪种_____、哪种_____方式引起的,综合这些信息,可分析分子中含有何种_____ 或 _____的信息。 例: 通过红外光谱图,发现未知物中含有O-H、C-H和C-O的振动吸收,可初步推测该未知物中含有羟基 ②质谱法在测定分子相对分子质量中的应用:现代化学常利用质谱仪测定分子的相对分子质量 原理:在质谱仪中使分子失去电子变成带_____的分子离子和碎片离子等粒子。由于生成的离子具有不同的相对质量,它们在高压电场加速后,通过狭缝进入磁场得以分离,在记录仪上呈现一系列峰,化学家对这些峰进行系统分析,便可得知样品分子的相对分子质量。 ③多样的分子空间结构 大多数分子是由两个以上原子构成的,于是分子就有了原子的几何学关系和形状,这就是分子的空间结构。 价层电子互斥模型 思考:三原子分子CO2和H2O、四原子分子NH3和CH2O,为什么它们的空间结构不同? 1940年,希吉维克和坡维尔在总结实验事实的基础上提出了一种简单的理论模型,用以预测简单分子或离子的立体结构。这种理论模型后经吉列斯比和尼霍尔姆在20世纪50年代加以发展,定名为价层电子对互斥模型,简称VSEPR (1) 观察上述分子的电子式,找出它们成键电子的的不同点? (2) 观察上述分子的电子式,再对照其球棍模型,运用分类、对比的方法,分析结构不同的原因。 结论;由于中心原子的孤电子对占有一定空间,对其他成键电子对存在排斥力,影响其分子的空间结构。 ①价层电子对: 分子的空间结构除了和中心原子与结合原子间的成键电子对有关,还和中心原子的孤电子对有关,两者合称为中心原子的“价层电子对” ②价层电子对互斥模型(VSEPR model) ABn 型:中心原子A的价层电子对(包括成键的_____ 和未成键的 _____)之间由于存在排斥力,将使分子的空间结构总是采取电子对_____最弱的那种结构,以使彼此之间_____ 最小,分子或离子的体系能量最低,最稳定;简单地说,分子的空间结构是中心原子的“价层电子对”相互排斥的结果 价层电子对的计算: 中心原子价层电子对数=σ键电子对数+孤电子对数 σ键电子对数的计算:由化学式确定,即中心原子形成几个σ键,就有几对σ键电子对 注:若ABn型分子中,A与B之间通过两对或三对电子(即通过双键或三键)结合而成,则价层电子对互斥模型把双键或三键作为一对电子对看待。 (2)中心原子上的孤电子对数的计算 中心原子上的孤电子对数=(a-xb) a表示中心原子的价电子数; 对主族元素:a= 最外层电子数 ; 对于阳离子:a= 价电子数-离子所带电荷数; 对于阴离子:a= 价电子数+离子所带电荷数 x表示与中心原子结合的原子数。 b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数 例1.SO2的中心原子为S,S的价电子数为___(即S的最外层电子数为___),则a=___;与中心原子S结合的O的个数为___,则x=___;与中心原子结合的O最多能接受的电子数为___,则b=___。所以,SO2 中的中心原子S上的孤电子对数为___ 例2.计算中心原子上 ... ...
~~ 您好,已阅读到文档的结尾了 ~~