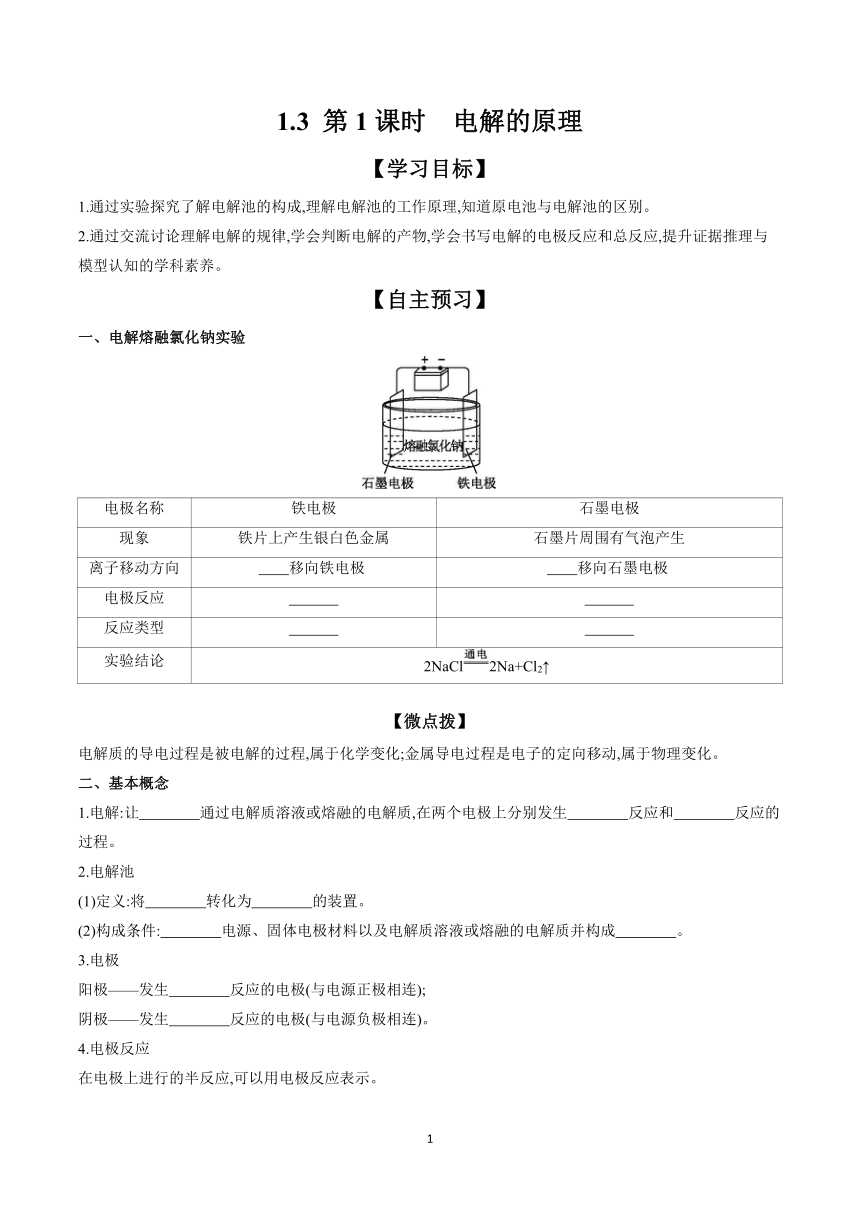
1.3 第1课时 电解的原理 【学习目标】 1.通过实验探究了解电解池的构成,理解电解池的工作原理,知道原电池与电解池的区别。 2.通过交流讨论理解电解的规律,学会判断电解的产物,学会书写电解的电极反应和总反应,提升证据推理与模型认知的学科素养。 【自主预习】 一、电解熔融氯化钠实验 电极名称 铁电极 石墨电极 现象 铁片上产生银白色金属 石墨片周围有气泡产生 离子移动方向 移向铁电极 移向石墨电极 电极反应 反应类型 实验结论 2NaCl2Na+Cl2↑ 【微点拨】 电解质的导电过程是被电解的过程,属于化学变化;金属导电过程是电子的定向移动,属于物理变化。 二、基本概念 1.电解:让 通过电解质溶液或熔融的电解质,在两个电极上分别发生 反应和 反应的过程。 2.电解池 (1)定义:将 转化为 的装置。 (2)构成条件: 电源、固体电极材料以及电解质溶液或熔融的电解质并构成 。 3.电极 阳极———发生 反应的电极(与电源正极相连); 阴极———发生 反应的电极(与电源负极相连)。 4.电极反应 在电极上进行的半反应,可以用电极反应表示。 三、电解池的工作原理 【参考答案】一、阳离子(Na+) 阴离子(Cl-) 2Na++2e-2Na 2Cl--2e-Cl2↑ 还原反应 氧化反应 二、1.直流电 氧化 还原 2.(1)电能 化学能 (2)直流 闭合回路 3. 氧化 还原 【效果检测】 1.判断正误(正确的打“√”,错误的打“×”)。 (1)与电源正极相连的是电解池的阴极。 ( ) (2)用惰性电极电解NaCl溶液时可以得到Na和Cl2。 ( ) (3)电解池工作时,阳极发生还原反应,失去电子。 ( ) (4)电解池工作时,阳极上的电子通过电解质溶液移向阴极。 ( ) (5)电解AgNO3溶液时,Ag+移向阳极,N移向阴极。 ( ) 【答案】(1)× (2)× (3)× (4)× (5)× 2.什么是电解 电解有什么特点 【答案】①概念:将电能转化为化学能的过程。 ②特点:a.电解是最强有力的氧化还原手段,是不可逆的;b.电解质溶液的导电过程,就是电解质溶液的电解过程。 3.如何判断一套装置是原电池还是电解池 【答案】看有无外接直流电源,有外接直流电源的是电解池,无外接直流电源的是原电池。 4.将下面的电极反应与对应的电极名称连线。 ①Na++e-Na ②氧化反应 A.阳极 ③还原反应 ④4OH--4e-2H2O+O2↑ B.阴极 【答案】①—B ②—A ③—B ④—A 【合作探究】 任务1:电解原理 情境导入 1807年,当英国化学家戴维将铂电极插入熔融的氢氧化钾并接通直流电源时,奇迹发生了,在阴极附近产生一种银白色的金属,随即形成紫色的火焰。这就是发现钾元素的主要过程,当时在社会上引起轰动。这其中的奥妙是什么 下面就让我们一起探讨吧! 问题生成 1.电解熔融的氢氧化钾过程中能量的转化形式是什么 【答案】电能转化为化学能。 2.从氧化还原反应角度分析,电解熔融的氢氧化钾的过程中阴极发生的反应类型是什么 阳极发生的反应类型是什么 【答案】阴极附近生成钾,钾元素化合价降低,发生还原反应,则阳极发生氧化反应。 3.分析电解熔融的氢氧化钾过程中电子的流向;电子通过熔融电解质吗 【答案】电子从电源负极流出,流入电解池阴极,从电解池阳极流回电源正极;不通过。 4.若戴维将熔融的氢氧化钾换成氢氧化钾溶液,他还能制得钾单质吗 为什么 若不能,得到的产物是什么 并写出阴、阳极反应和总反应。 【答案】不能;因为溶液中存在H+,H+放电顺序优先于K+。得到的产物是H2和O2; 阳极反应:2H2O-4e-O2↑+4H+; 阴极反应:4H2O+4e-2H2↑+4OH-; 总反应:2H2O2H2↑+O2↑。 5.若将铂电极换成铜电极,电解氢氧化钾溶液,电解产物和问题4相同吗 若不同,请写出阴、阳极反应和总反应。 【答案】不同。阳极反应: ... ...
~~ 您好,已阅读到文档的结尾了 ~~

