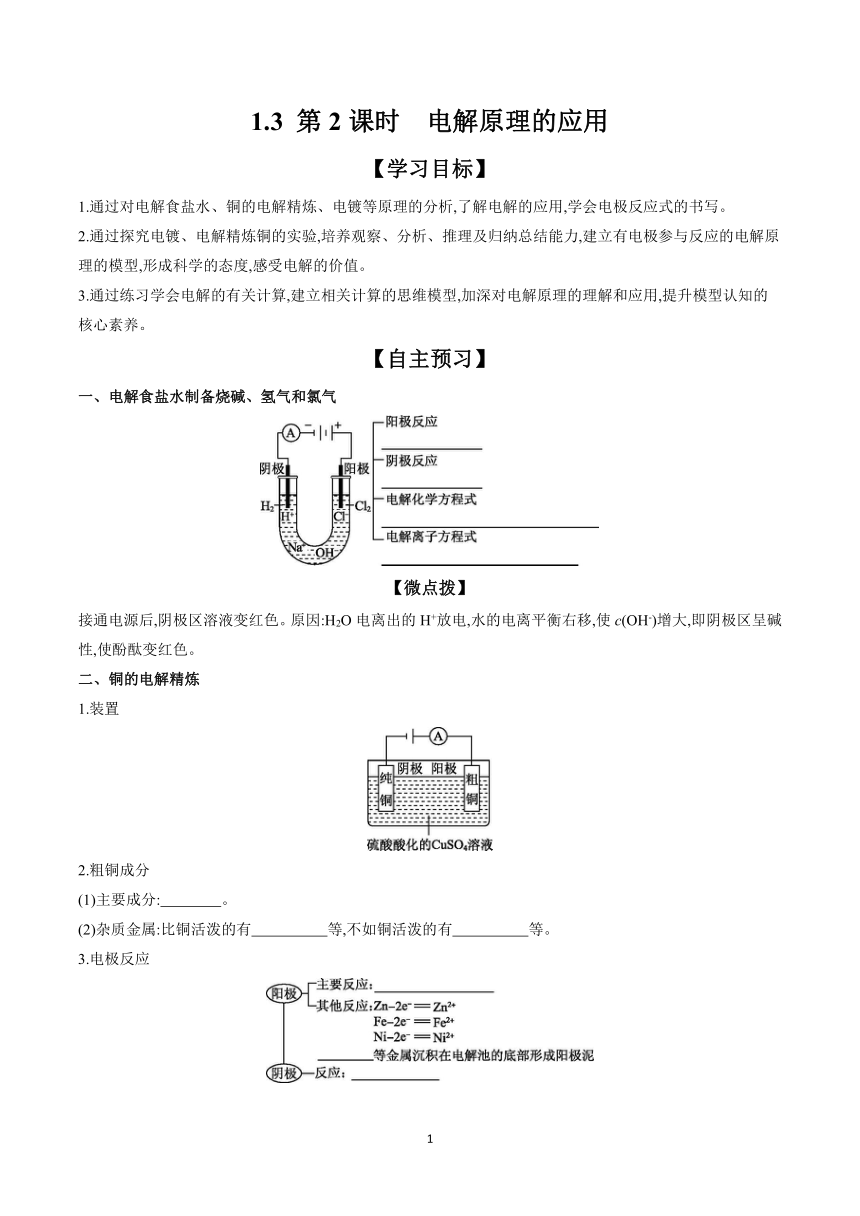
1.3 第2课时 电解原理的应用 【学习目标】 1.通过对电解食盐水、铜的电解精炼、电镀等原理的分析,了解电解的应用,学会电极反应式的书写。 2.通过探究电镀、电解精炼铜的实验,培养观察、分析、推理及归纳总结能力,建立有电极参与反应的电解原理的模型,形成科学的态度,感受电解的价值。 3.通过练习学会电解的有关计算,建立相关计算的思维模型,加深对电解原理的理解和应用,提升模型认知的核心素养。 【自主预习】 一、电解食盐水制备烧碱、氢气和氯气 【微点拨】 接通电源后,阴极区溶液变红色。原因:H2O电离出的H+放电,水的电离平衡右移,使c(OH-)增大,即阴极区呈碱性,使酚酞变红色。 二、铜的电解精炼 1.装置 2.粗铜成分 (1)主要成分: 。 (2)杂质金属:比铜活泼的有 等,不如铜活泼的有 等。 3.电极反应 【微点拨】 (1)粗铜中含Zn、Fe、Ag等杂质,同时间段内两电极改变的质量不相等,但两电极通过的电量相等。 (2)电解过程中,阴离子浓度不变,Cu2+的浓度减小,Fe2+、Zn2+、Ni2+的浓度增大。 三、电镀 1.定义:应用电解原理,在金属表面镀上一薄层金属或合金的方法。 2.目的:增强金属的抗腐蚀能力、耐磨性能或改善金属制品的外观。 3.根据电解原理,设计在铁钉上镀铜的实验方案 电 镀 原 理 阳极: Cu-2e-Cu2+ 阴极: Cu2++2e-Cu 电 镀 方 案 电极材料 阳极:铜片 阴极:铁钉 电镀液 CuSO4溶液 镀件 铁钉 【微点拨】 电镀的特点:“一多、一少、一不变”。 (1)一多:指阴极上有镀层金属沉积; (2)一少:指阳极上有镀层金属溶解; (3)一不变:指电镀后,电解质溶液中的离子浓度保持不变。 四、钒液流电池 以全钒液流电池为例,酸性溶液中钒通常以V2+、V3+、VO2+、V等形式存在。充电时,VO2+在阳极被氧化为V,V3+在阴极被还原为V2+。以液流电池为代表的电化学储能技术可为可再生能源发电提供有力的支持,缓冲昼夜、季节的用电变化对电网的影响。 【参考答案】一、2Cl--2e-Cl2↑ 2H++2e-H2↑ 2NaCl+2H2OH2↑+Cl2↑+2NaOH 2Cl-+2H2OH2↑+Cl2↑+2OH- 二、2.(1)Cu (2)Zn、Fe、Ni Ag、Pt、Au 3.Cu(粗铜)-2e-Cu2+ Ag、Pt、Au Cu2++2e-Cu(精铜) 【效果检测】 1.判断正误(正确的打“√”,错误的打“×”)。 (1)氯碱工业中,阳极区产生H2和NaOH。 ( ) (2)精炼铜装置中,粗铜作阴极,精铜作阳极。 ( ) (3)精炼铜过程中,电解质溶液中c(Cu2+)不变。 ( ) (4)电镀装置中,镀件作阴极,待镀金属作阳极。 ( ) (5)电镀过程中,电解质溶液的浓度减小。 ( ) 【答案】(1)× (2)× (3)× (4)√ (5)× 2.以惰性电极分别电解熔融氯化钠和氯化钠溶液时,电极反应有何差异 写出有关电极反应和总反应方程式。 【答案】两者阴极反应不同。电解熔融氯化钠时,阴极反应为2Na++2e-2Na,总反应为2NaCl(熔融)2Na+Cl2↑;电解食盐水时,阴极反应为2H++2e-H2↑,总反应为2NaCl+2H2O2NaOH+Cl2↑+H2↑。 3.电解饱和食盐水的工业生产为什么叫作氯碱工业 在什么装置中进行 【答案】烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫作氯碱工业。工业生产中,这个反应在离子交换膜电解槽中进行。 【合作探究】 任务1:电解在氯碱工业中的应用 情境导入 工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2),并以它们为原料生产一系列化工产品,称为氯碱工业。氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业以及石油化学工业。氯碱工业主要有隔膜法、离子交换膜法等工艺。 【实验探究】 电解饱和食盐水 电解饱和食盐水原理示意图 符号表征 阳极反应 2Cl--2e-Cl2↑ 阴极反应 2H2O+2e-H2↑+2OH- 总反应离子方程式 2Cl-+2H2OH2↑+Cl2↑+2OH- 总反应化学方程式 2 ... ...
~~ 您好,已阅读到文档的结尾了 ~~