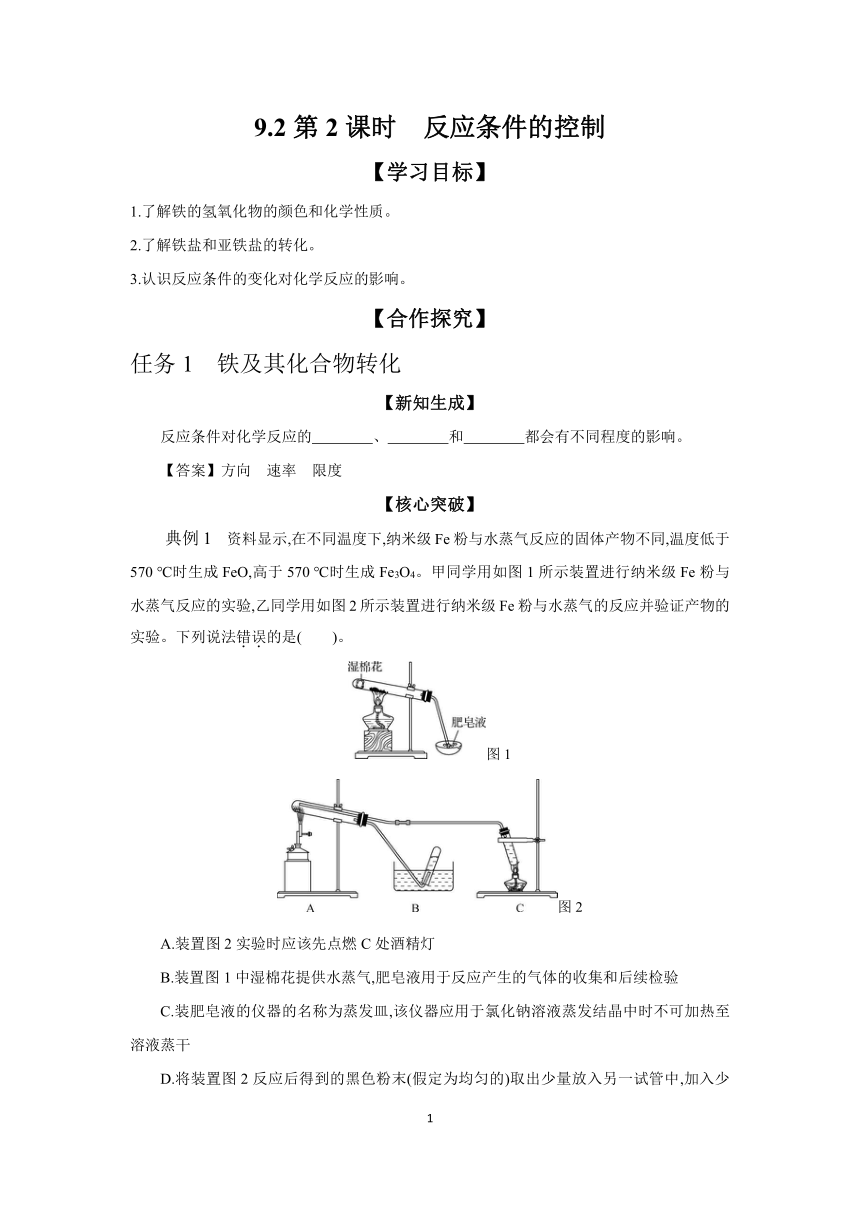
9.2第2课时 反应条件的控制 【学习目标】 1.了解铁的氢氧化物的颜色和化学性质。 2.了解铁盐和亚铁盐的转化。 3.认识反应条件的变化对化学反应的影响。 【合作探究】 任务1 铁及其化合物转化 【新知生成】 反应条件对化学反应的 、 和 都会有不同程度的影响。 【答案】方向 速率 限度 【核心突破】 典例1 资料显示,在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570 ℃时生成FeO,高于570 ℃时生成Fe3O4。甲同学用如图1所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用如图2所示装置进行纳米级Fe粉与水蒸气的反应并验证产物的实验。下列说法错误的是( )。 图1 图2 A.装置图2实验时应该先点燃C处酒精灯 B.装置图1中湿棉花提供水蒸气,肥皂液用于反应产生的气体的收集和后续检验 C.装肥皂液的仪器的名称为蒸发皿,该仪器应用于氯化钠溶液蒸发结晶中时不可加热至溶液蒸干 D.将装置图2反应后得到的黑色粉末(假定为均匀的)取出少量放入另一试管中,加入少量盐酸,微热,再滴加几滴KSCN溶液,振荡,溶液没有出现血红色,则装置A的产物为FeO 【答案】D 【解析】图2实验中C处提供水蒸气,为防止Fe与氧气反应,应先点燃C处酒精灯,用水蒸气排出空气,A项正确;图1中湿棉花提供水蒸气,高温下与Fe反应生成氢气可吹肥皂液,点燃可检验氢气,则肥皂液用于反应产生的气体的收集和后续检验,B项正确;装肥皂液的仪器的名称为蒸发皿,蒸发皿可进行蒸发实验,该仪器还可用于氯化钠的蒸发结晶,不能蒸干,利用余热加热,出现大量固体时停止加热,C项正确;若生成四氧化三铁,且Fe剩余时,加入少量盐酸,微热,再滴加几滴KSCN 溶液,振荡,溶液没有出现血红色,则乙中产物不一定为FeO,D项错误。 【归纳总结】 Fe只具有还原性,可以被氧化剂氧化为Fe2+、Fe3+ 如Fe+SFeS;Fe+2Fe3+3Fe2+;Fe+Cu2+Cu+Fe2+;2Fe+3Cl22FeCl3。 铁及其化合物的转化———�铁三角” 铁元素有三种常见价态:0价、+2价和+3价,这三种价态的铁在一定条件下可相互转化,我们称之为“铁三角”。 训练1 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题: (1)写出A、C、F、G的化学式: A ;C ; F ;G 。 (2)检验D中阳离子的方法为 。 (3)保存C溶液时要加固体A的原因是 。 (4)写出下列转化的离子方程式: ①D→C: 。 ②C→D: 。 (5)写出E→F反应的化学方程式: 。 【答案】(1)Fe FeCl2 Fe(OH)3 Fe2O3 (2)取D溶液少许于试管中,加入几滴KSCN溶液,溶液变红色,证明含Fe3+ (3)防止Fe2+被O2氧化 (4)①2Fe3++Fe3Fe2+ ②2Fe2++Cl22Fe3++2Cl- (5)4Fe(OH)2+O2+2H2O4Fe(OH)3 【解析】根据F是红褐色沉淀知F是Fe(OH)3,从而推知A为Fe,B为Fe3O4,C是FeCl2,D是FeCl3,E为Fe(OH)2,F为Fe(OH)3,G为Fe2O3,X为H2。 任务2 铁的氢氧化物 【新知生成】 制备氢氧化亚铁时,生成物应尽量避免与空气中的 接触,防止发生反应: 。 【答案】氧气 4Fe(OH)2+O2+2H2O4Fe(OH)3 【核心突破】 典例2 下列各图示实验中能较长时间观察到Fe(OH)2白色沉淀的是( )。 ① ② ③ A.①② B.①③ C.②③ D.①②③ 【答案】B 【解析】因为Fe(OH)2在空气中易被氧化成Fe(OH)3,故要长时间观察到Fe(OH)2白色沉淀,就要排除装置中的空气或氧气。装置①是先用铁与稀硫酸反应生成的H2将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中,③中液面上加苯阻止了生成的Fe(OH)2与空气接触;②由于能接触空气中的O2,故不能较长时间观察到白色沉淀。 【归纳总结】 氢氧化亚铁制备注意事项 在实验室制备氢氧化亚铁时,一定要用新制的 ... ...
~~ 您好,已阅读到文档的结尾了 ~~