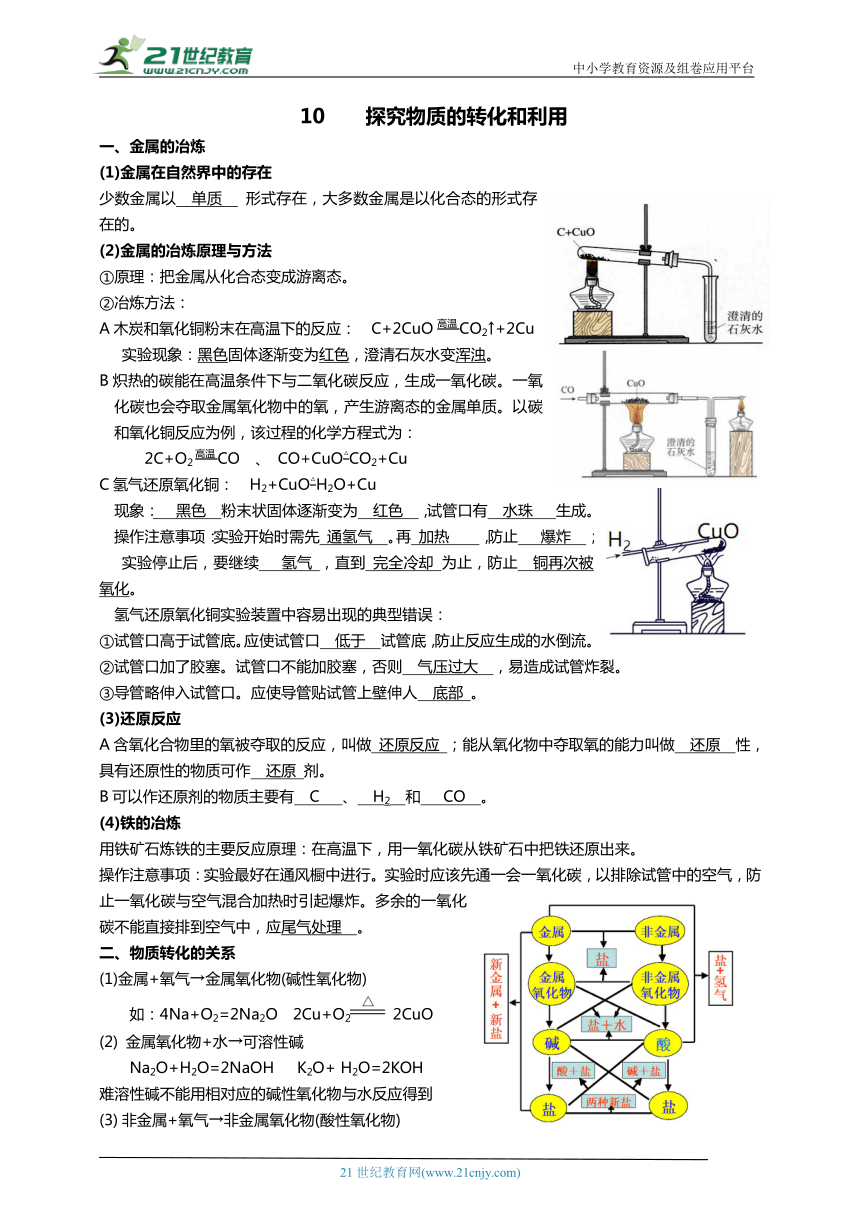
中小学教育资源及组卷应用平台 10 探究物质的转化和利用 一、金属的冶炼 (1)金属在自然界中的存在 少数金属以 单质 形式存在,大多数金属是以化合态的形式存在的。 (2)金属的冶炼原理与方法 ①原理:把金属从化合态变成游离态。 ②冶炼方法: A木炭和氧化铜粉末在高温下的反应: C+2CuO高温CO2↑+2Cu 实验现象:黑色固体逐渐变为红色,澄清石灰水变浑浊。 B炽热的碳能在高温条件下与二氧化碳反应,生成一氧化碳。一氧化碳也会夺取金属氧化物中的氧,产生游离态的金属单质。以碳和氧化铜反应为例,该过程的化学方程式为: 2C+O2高温CO 、 CO+CuO△CO2+Cu C氢气还原氧化铜: H2+CuO△H2O+Cu 现象: 黑色 粉末状固体逐渐变为 红色 ,试管口有 水珠 生成。 操作注意事项:实验开始时需先 通氢气 。再 加热 ,防止 爆炸 ; 实验停止后,要继续 氢气 ,直到 完全冷却 为止,防止 铜再次被氧化。 氢气还原氧化铜实验装置中容易出现的典型错误: ①试管口高于试管底。应使试管口 低于 试管底,防止反应生成的水倒流。 ②试管口加了胶塞。试管口不能加胶塞,否则 气压过大 ,易造成试管炸裂。 ③导管略伸入试管口。应使导管贴试管上壁伸人 底部 。 (3)还原反应 A含氧化合物里的氧被夺取的反应,叫做 还原反应 ;能从氧化物中夺取氧的能力叫做 还原 性,具有还原性的物质可作 还原 剂。 B可以作还原剂的物质主要有 C 、 H2 和 CO 。 (4)铁的冶炼 用铁矿石炼铁的主要反应原理:在高温下,用一氧化碳从铁矿石中把铁还原出来。 操作注意事项:实验最好在通风橱中进行。实验时应该先通一会一氧化碳,以排除试管中的空气,防止一氧化碳与空气混合加热时引起爆炸。多余的一氧化碳不能直接排到空气中,应尾气处理 。 二、物质转化的关系 (1)金属+氧气→金属氧化物(碱性氧化物) 如:4Na+O2=2Na2O 2Cu+O2 2CuO (2) 金属氧化物+水→可溶性碱 Na2O+H2O=2NaOH K2O+ H2O=2KOH 难溶性碱不能用相对应的碱性氧化物与水反应得到 非金属+氧气→非金属氧化物(酸性氧化物) 如:C+ O2CO2 非金属氧化物不一定都是酸性氧化物,学过的酸性氧化物有CO2 、SO2 、P2O5 (4)酸性氧化物+水→可溶性含氧酸 如: CO2+ H2O=H2CO3 SO2+ H2O=H2SO3 H2SiO3是难溶性酸,所以不能用对应的酸性氧化物SiO2与水化合而制得 (5)金属+非金属→无氧酸盐 如:2Na+Cl2点燃2NaCl (6)金属氧化物+非金属氧化物→含氧酸盐 如:Na2O+CO2=Na2CO3 (7)金属氧化物+酸→盐+水 如:Fe2O3+6HCl=2FeCl3+3H2O (8)非金属氧化物+碱→盐+水 如:CO2+2NaOH=Na2CO3+H2O (9)酸+碱→盐+水 如:HCl+NaOH=NaCl+H2O (10)可溶性碱+可溶性盐→新碱+新盐(其中有一种为沉淀) 如:3NaOH+ FeCl3=3NaCl +Fe(OH)3↓ (11)酸+盐→新酸+新盐(条件:酸可溶于水,且生成物中要有沉淀、气体或水) 如:H2SO4+BaCl2=2HCl+BaSO4↓ (12)盐+盐→新盐+新盐(条件:反应物均溶于水且生成物中要有沉淀) 如:NaCl+AgNO3=AgCl↓+NaNO3 (13)金属+盐→新金属+新盐 如:Fe+CuSO4=Cu+FeSO4 (14)金属+酸→盐+氢气 如:Fe+2HCl= FeCl2+H2 ↑ 条件:酸是除浓硫酸和浓硝酸以外的酸,且参加反应的金属是金属活动性顺序表中氢以前的金属 (15)碱→碱性氧化物+水:2Fe(OH)3 Fe2O3+ 3H2O (16)酸→酸性氧化物+水:H2CO3 CO2↑+ H2O 三、典型例题 【例1】某混合气体可能有CO2、CO、H2中的一种或几种,某学习小组的同学为了探究气体的组成,设计了如下装置进行实验(夹持装置已省略)。实验中出现的现象及在反应前后测量C、D装置的质量(各步反应均完全)记录如下表: 试分析回答下列问题: (1)请写出A装置中反应的化学方程式_____。 (2)能证明原混合气体中有氢气存在的实验现象应该是_____。 (3)若混合气体中含有CO,则a、b、c、d之间满足的关系式为_ ... ...
~~ 您好,已阅读到文档的结尾了 ~~

