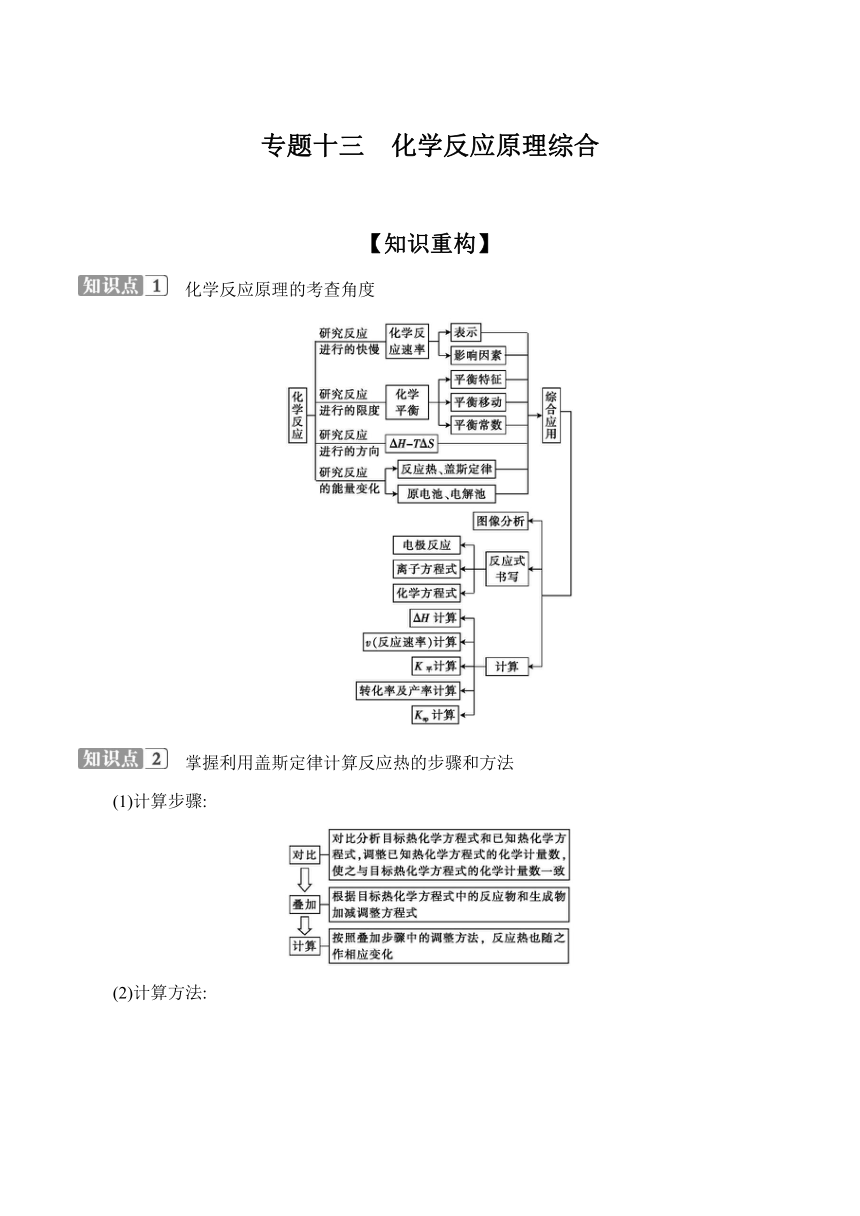
专题十三 化学反应原理综合 【知识重构】 化学反应原理的考查角度 掌握利用盖斯定律计算反应热的步骤和方法 (1)计算步骤: (2)计算方法: 正确理解化学反应速率的影响因素 (1)“惰性气体”对反应速率的影响 ①恒温恒容:充入“惰性气体”总压增大参与反应的各物质浓度不变(活化分子浓度不变)反应速率不变。 ②恒温恒压:充入“惰性气体”体积增大参与反应的各物质浓度减小(活化分子浓度减小)反应速率减小。 (2)纯液体、固体对化学反应速率的影响 在化学反应中,纯液体和固体的浓度为常数,故不能用纯液体和固体的浓度变化来表示反应速率,但是固态反应物颗粒的大小是影响反应速率的因素之一,如煤粉由于表面积大,燃烧得比煤块快。 (3)外界条件对可逆反应的正、逆反应速率的影响 条件改变 影响 增大反应 物浓度 v正瞬间增大,v逆瞬间不变,随后也增大 增大压强 v正和v逆都增大,气体分子数减小的方向的反应速率增大的程度大 对无气体参加或生成的化学反应的速率无影响 反应前后气体分子数不变的反应,正、逆反应速率同等程度地增大 升高温度 v正和v逆都增大,但吸热反应方向的反应速率增大的程度大 使用催化剂 能同等程度地改变正、逆反应速率 突破化学平衡状态的判断 (1)注意“三关注”:一要关注反应条件,是恒温恒容、恒温恒压还是绝热恒容、绝热恒压;二要关注反应特点,是等体积反应,还是非等体积反应;三要关注特殊情况,是否有固体参加或生成,是否有固体的分解反应。 (2) (3)从现象上判断 影响化学平衡的因素 改变的条件(其他条件不变) 化学平衡移动的方向 浓度 增大反应物浓度或减小生成物浓度 向正反应方向移动 减小反应物浓度或增大生成物浓度 向逆反应方向移动 压强(对有气体参加的反应) 反应前后气体 体积改变 增大压强 向气体分子总数减小的方向移动 减小压强 向气体分子总数增大的方向移动 反应前后气体 体积不变 改变压强 平衡不移动 温度 升高温度 向吸热反应方向移动 降低温度 向放热反应方向移动 催化剂 同等程度改变v正、v逆,平衡不移动 化学能与电能的转化 (1)判断是原电池还是电解池,根据装置图中物质的变化判断发生氧化反应还是还原反应,或根据离子的移动方向等,确定电解池(或原电池)的电极名称。 (2)结合电解池原理(或原电池原理)书写电极反应,结合电路中转移电子守恒进行相关计算。 【题型解码】 题型1 化工生产中条件选择与控制 例1 (2024·全国甲卷)甲烷转化为多碳化合物具有重要意义。一种将甲烷溴化再偶联为丙烯(C3H6)的研究所获得的部分数据如下。回答下列问题: (1)已知如下热化学方程式: CH4(g)+Br2(g)CH3Br(g)+HBr(g) ΔH1=-29 kJ·mol-1 3CH3Br(g)C3H6(g)+3HBr(g) ΔH2=+20 kJ·mol-1 计算反应3CH4(g)+3Br2(g)C3H6(g)+6HBr(g)的ΔH= kJ·mol-1。 (2)CH4与Br2反应生成CH3Br,部分CH3Br会进一步溴化。将8 mmol CH4和8 mmol Br2通入密闭容器,平衡时,n(CH4)、n(CH3Br)与温度的关系见下图(假设反应后的含碳物质只有CH4、CH3Br和CH2Br2)。 (ⅰ)图中CH3Br的曲线是 (填“a”或“b”)。 (ⅱ)560 ℃时,CH4的转化率α= ,n(HBr)= mmol。 (ⅲ)560 ℃时,反应CH3Br (g)+Br2(g)CH2Br2(g)+HBr(g)的平衡常数K= 。 (3)少量I2可提高生成CH3Br的选择性。500 ℃时,分别在有I2和无I2的条件下,将8 mmol CH4和8 mmol Br2通入密闭容器,溴代甲烷的物质的量(n)随时间(t)的变化关系见下图。 (ⅰ)在11~19 s之间,有I2和无I2时CH3Br的生成速率之比= 。 (ⅱ)从图中找出I2提高了CH3Br选择性的证据: 。 (ⅲ)研究表明,I2参与反应的可能机理如下: ①I2(g)·I(g)+·I(g) ②·I(g)+CH2Br2(g)IBr(g)+·CH2Br(g) ③·CH2Br(g)+HBr(g)CH3Br(g)+·Br(g) ... ...
~~ 您好,已阅读到文档的结尾了 ~~