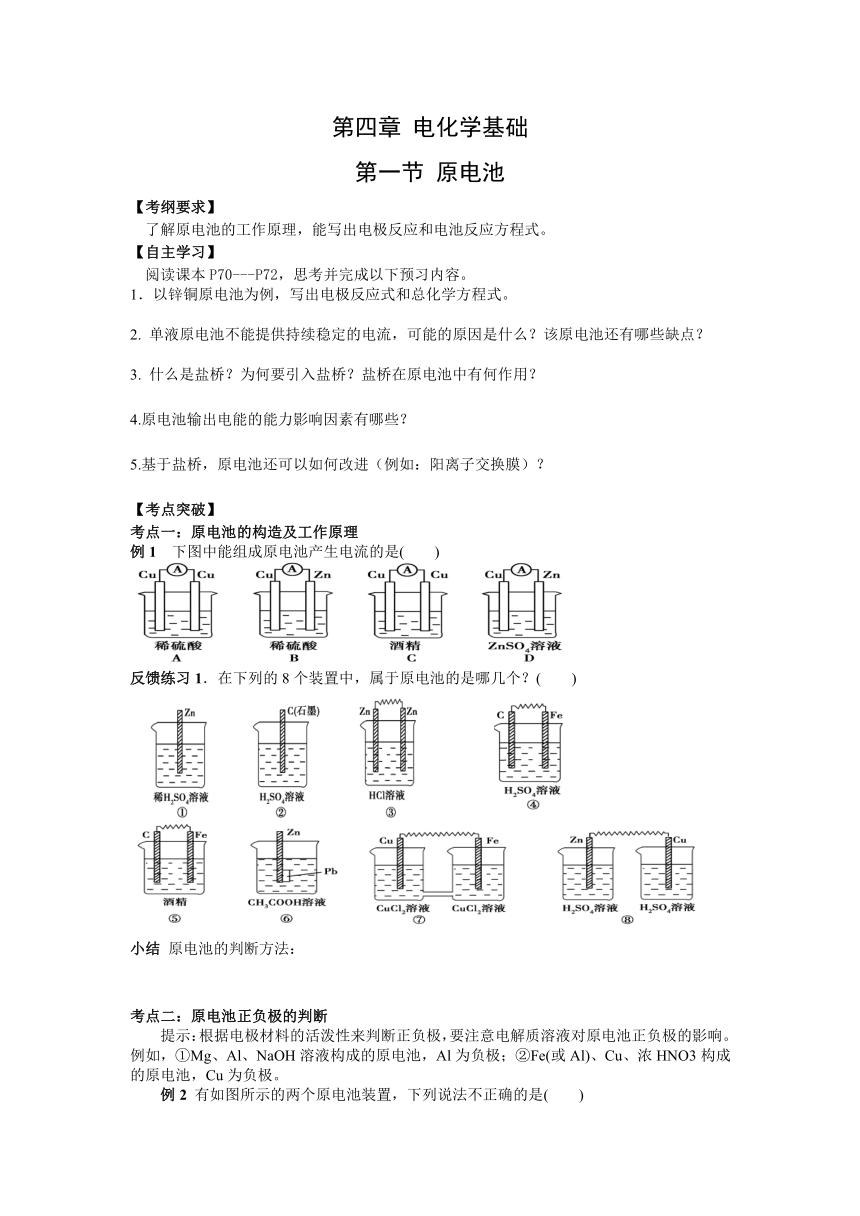
第四章 电化学基础 第一节 原电池 【考纲要求】 了解原电池的工作原理,能写出电极反应和电池反应方程式。 【自主学习】 阅读课本P70--P72,思考并完成以下预习内容。 1.以锌铜原电池为例,写出电极反应式和总化学方程式。 2. 单液原电池不能提供持续稳定的电流,可能的原因是什么?该原电池还有哪些缺点? 3. 什么是盐桥?为何要引入盐桥?盐桥在原电池中有何作用? 4.原电池输出电能的能力影响因素有哪些? 5.基于盐桥,原电池还可以如何改进(例如:阳离子交换膜)? 【考点突破】 考点一:原电池的构造及工作原理 例1 下图中能组成原电池产生电流的是( ) 反馈练习1.在下列的8个装置中,属于原电池的是哪几个?( ) 小结 原电池的判断方法: 考点二:原电池正负极的判断 提示:根据电极材料的活泼性来判断正负极,要注意电解质溶液对原电池正负极的影响。例如,①Mg、Al、NaOH溶液构成的原电池,Al为负极;②Fe(或Al)、Cu、浓HNO3构成的原电池,Cu为负极。 例2 有如图所示的两个原电池装置,下列说法不正确的是( ) A.A池中负极的电极反应为Mg-2e-===Mg2+ B.Mg在A池中为负极,在B池中为正极 C.B池中电子的流向:Mg→Al D.原电池工作一段时间后,A池溶液的pH会增大 反馈练习2.铜锌原电池(如图)工作时,下列叙述正确的是( ) A.正极反应为:Zn-2e-===Zn2+ B.电池反应为:Zn+Cu2+===Zn2++Cu C.在外电路中,电流从负极流向正极 D.盐桥中的K+移向ZnSO4溶液 反馈练习3下列说法中不正确的是 ( ) A.由 Al、Cu、稀H2SO4组成原电池,其负极反应式为: Al-3e-= Al3+ B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为: Al-3e-= Al3+ C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为: Cu-2e-= Cu2+ D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-= Cu2+ 小结 原电池正负极判断方法: 考点三:原电池原理的应用(设计原电池、比较金属活泼性、金属防护、加快速率) 例3 ①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是( ) A.①③②④ B.①③④② C.③④②① D.③①②④ 例4 利用反应Zn+2FeCl3==ZnCl2+2FeCl2, 设计一个原电池,在下边方框内画出实验装置图, 并指出正极为_____,电极反应式为_____; 负极为_____,电极反应式为_____。 反馈练习4 有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的金属活动性由强到弱的顺序是( ) A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C 反馈练习5 为什么实验室用锌与稀H2SO4反应制H2,在其他条件相同的条件下,用粗锌产生H2的速率会更快? 反馈练习6 为何海船船底要附一块锌? 反馈练习7 某电池的总反应为: Fe+2Fe3+===3Fe2+,能实现该反应的原电池是( ) 正极 负极 电解质溶液 A Cu Fe FeCl3溶液 B C Fe Fe(NO3)2溶液 C Fe Zn Fe2(SO4)3溶液 D Ag Fe CuSO4溶液 【考点巩固】 1.下列化学反应在理论上可设计成原电池的是( ) A.2Al(s)+2NaOH(aq)+2H2O(l)===2NaAlO2(aq)+3H2(g) ΔH<0 B.HNO3(aq)+KOH(aq)===KNO3(aq)+H2O(l) ΔH<0 C. Ba(OH)2·H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0 D.Na2O(s)+H2O(l)===2NaOH(aq) ΔH<0 2. 将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

