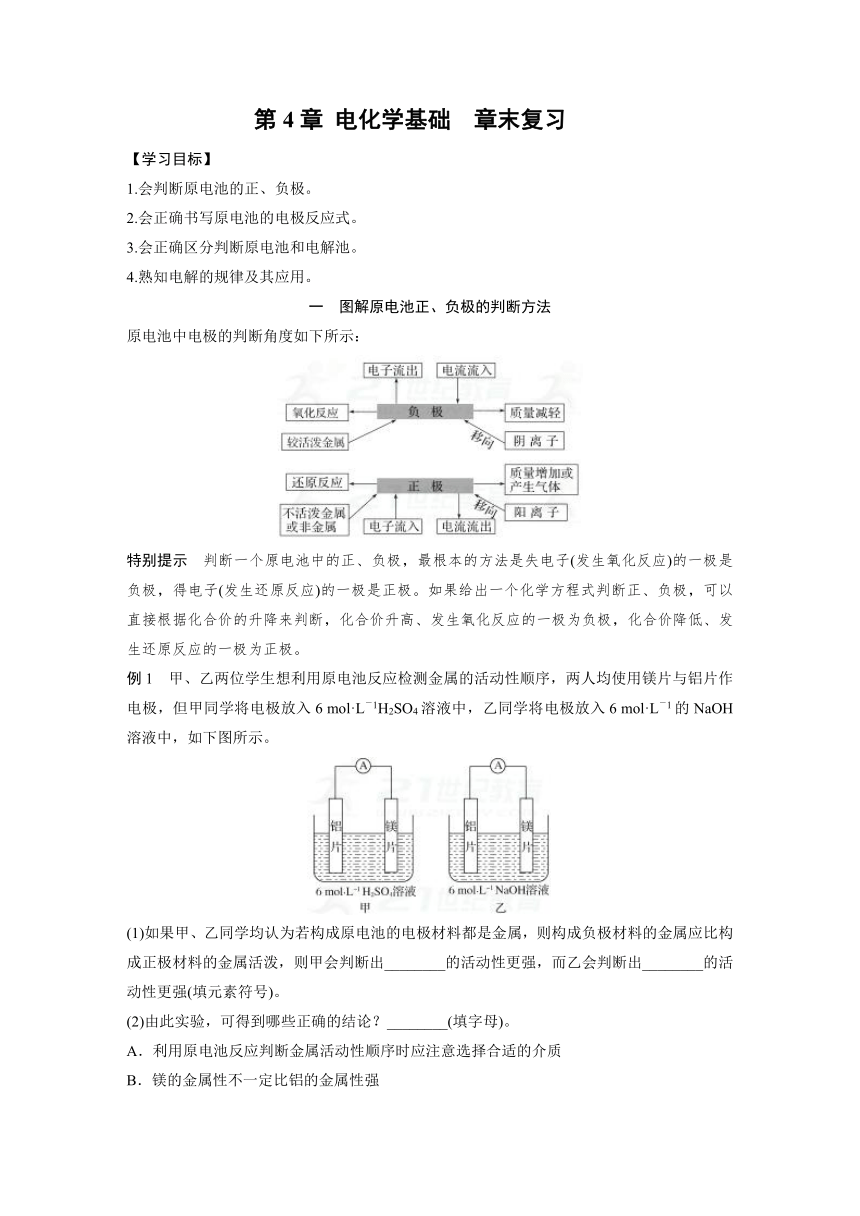
第4章 电化学基础 章末复习 【学习目标】 1.会判断原电池的正、负极。 2.会正确书写原电池的电极反应式。 3.会正确区分判断原电池和电解池。 4.熟知电解的规律及其应用。 一 图解原电池正、负极的判断方法 原电池中电极的判断角度如下所示: 特别提示 判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高、发生氧化反应的一极为负极,化合价降低、发生还原反应的一极为正极。 例1 甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如下图所示。 (1)如果甲、乙同学均认为若构成原电池的电极材料都是金属,则构成负极材料的金属应比构成正极材料的金属活泼,则甲会判断出_____的活动性更强,而乙会判断出_____的活动性更强(填元素符号)。 (2)由此实验,可得到哪些正确的结论?_____(填字母)。 A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 B.镁的金属性不一定比铝的金属性强 C.该实验说明金属活动性顺序表已过时,已没有实用价值 D.该实验说明化学研究的对象复杂,反应受条件影响较大,因此应具体问题具体分析 (3)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池的正、负极”的做法_____(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正、负极的可行的实验方案: _____ _____(如可靠,此空可不填)。 二 原电池电极反应式的书写规律和方法 1.根据装置书写电极反应式 (1)先分析题目给定的图示装置,确定原电池正、负极上的反应物,并标出相同数目电子的得失。 (2)负极反应式的书写 常见电池 负极反应特点 负极反应式书写方法 锌锰干电池(Zn-C-NH4Cl) ①负极(Zn)本身失去电子生成阳离子(Zn2+)②生成的阳离子不与电解质溶液成分反应 直接写出负极反应式:Zn-2e-===Zn2+ 铅蓄电池(Pb-PbO2-H2SO4) ①负极(Pb)本身失去电子生成阳离子(Pb2+)②生成的阳离子(Pb2+)与电解质溶液成分(SO)反应 将①和②进行叠加:Pb-2e-+SO===PbSO4 甲烷燃料电池(Pt-Pt-KOH) ①负极本身不反应,燃料失去电子被氧化②燃料反应产物与电解质溶液成分有些能反应 将①和②进行叠加:CH4-8e-+10OH-===CO+7H2O (3)正极反应式的书写 ①首先判断在正极发生反应的物质:当负极材料与电解质溶液能自发的发生化学反应时,在正极上发生电极反应的物质是电解质溶液中的某种微粒;当负极材料与电解质溶液不能自发的发生化学反应时,在正极上发生反应的物质是溶解在电解质溶液中的O2。 ②然后再根据具体情况写出正极反应式,在书写时也要考虑正极反应产物是否与电解质溶液反应的问题,若参与反应也要书写叠加式。 ③燃料电池的正极反应式 电解质是碱性或中性溶液:O2+2H2O+4e-===4OH-, 电解质是酸性溶液:O2+4H++4e-===2H2O。 (4)正、负电极反应式相加得到电池反应的总反应方程式。 2.根据总反应式书写电极反应式 如果题目给定的是总反应式,可分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),再选择一个简单变化情况写电极反应式,另一极的电极反应式可直接写或将各反应式看作数学中的代数式,用总反应式减去已写出的电极反应式即得结果。 以2H2+O2===2H2O为例,当电解质溶液为KOH溶液时的电极反应式的书写步骤如下: (1)根据总反应方程式分析有关元素化合价的变化情况,确定2 mol H2失掉4 mol电子,初步确定负极反应式为2H2-4e-===4H+。 (2)根据电解质溶液为碱性,与H+不能大量共存, ... ...
~~ 您好,已阅读到文档的结尾了 ~~

