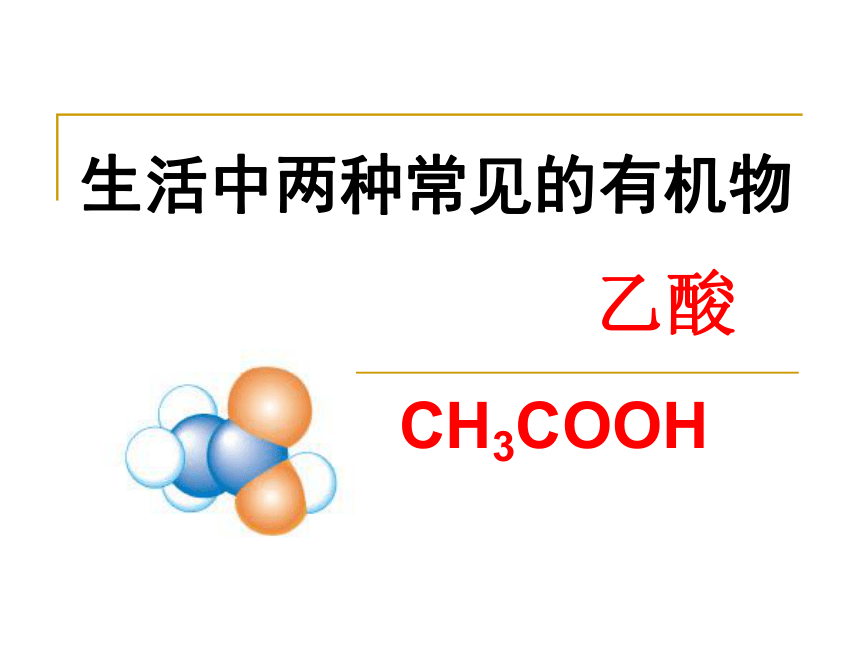
课件21张PPT。CH3COOH生活中两种常见的有机物 乙酸存放的黄酒为什么会变酸?黄酒为什么有酸味酉廿一日醋的来历乙醛 乙酸 杜康 (父亲) 黑塔 (儿子)酿酒技术乙醇酒糟氧化氧化醋酸颜色、状态: 气味: 观察:无水乙酸无色液体有强烈刺激性气味117.9℃ (易挥发) 16.6℃(当温度低于16.6℃时,乙酸凝结成冰一样的晶体,无水乙酸称冰醋酸)易溶于水、乙醇等有机溶剂一、乙酸的物理性质:沸点: 熔点: 溶解性:二、乙酸的分子组成与结构简写为甲基羧基(官能团)羟基羰基C2H4O2CH3COO— + H+乙酸的电离实验探究1:乙酸的化学性质 酸性实验设计:根据下列药品设计实验 证明乙酸的确有酸性药品:乙酸溶液、镁条、 Na2CO3溶液、紫色石蕊溶液。有哪些可行方案2CH3COOH + Na2CO3 → 2CH3COONa+CO2↑+H2O方案一:向盛有乙酸溶液的试管中加入紫色石蕊溶液Mg + 2CH3COOH → (CH3COO)2Mg + H2↑ 方案二:向盛乙酸溶液的试管中插入镁条 方案三:向盛有Na2CO3溶液的试管中加入乙酸溶液 三、乙酸的化学性质1.酸的通性 (现象及反应方程式)现象:紫色石蕊溶液变红 乙酸还能和哪类物质反应?乙酸和碳酸酸性强弱?产生气泡 [思考实践]如何除去水壶中的水垢?水垢主要成份: Mg(OH)2 CaCO3会发生哪些反应?水垢主要成份:Mg(OH)2和CaCO32CH3COOH + CaCO3 = (CH3COO)2Ca +H2O+CO2↑判断酸性强弱顺序:�酸性:CH3COOH>H2CO3Mg(OH)2 + 2CH3COOH = (CH3COO)2Mg + 2H2O 乙酸酸性的应用:除水垢没有酒味 也没有酸味挥发了? 反应了?烧鱼时常加醋并加点酒,这样鱼的味道就变得 无腥、香醇,特别鲜美。实验探究2:乙酸与乙醇的酯化反应 液面上有 透明的 不溶于水的 有香味的 油状液体产生乙醇+浓硫酸+乙酸实验思考:催化剂、吸水剂1、浓H2SO4作用:3、饱和Na2CO3的作用:溶解乙醇 中和乙酸 降低乙酸乙酯的溶解度乙酸乙酯的实验室制备2、得到的乙酸乙酯中含有那些杂质?挥发出的乙醇和乙酸2、酯化反应定义:酸和醇反应,生成酯和水的反应叫做酯化反应。乙酸乙酯(香味)三、乙酸的化学性质思考:酯化反应原理及乙醇和乙酸形成乙酸乙酯的断键方式? 可逆反应可能一可能二 探究:酯化反应的本质�———酯化反应的脱水方式酸(羧基)脱羟基醇(羟基)脱氢。酯化反应类型:取代反应。通过同位素原子示踪法测得反应实质:酯天然的酯!合成的酯! O CH3—C—O—H 酸性酯化反应小结:是一种重要的化工原料:广泛用于合成纤维、涂料、医药、农药、食品添加剂、染织等工业。 在日常生活中也有广泛的用途四、乙酸的用途一.乙酸的物理性质 二.乙酸的分子组成与结构 结构简式: 官能团: 三.乙酸的化学性质 1.乙酸的酸性 乙酸是一种一元弱酸,其酸性强于碳酸 2.乙酸的酯化反应 CH3COOH—COOH(羧基)四、乙酸的用途通过这节课的学习,你有什么收获?实践:运用今天所学的知识, 帮助父母做一件家务。谢谢光临指导 ... ...
~~ 您好,已阅读到文档的结尾了 ~~