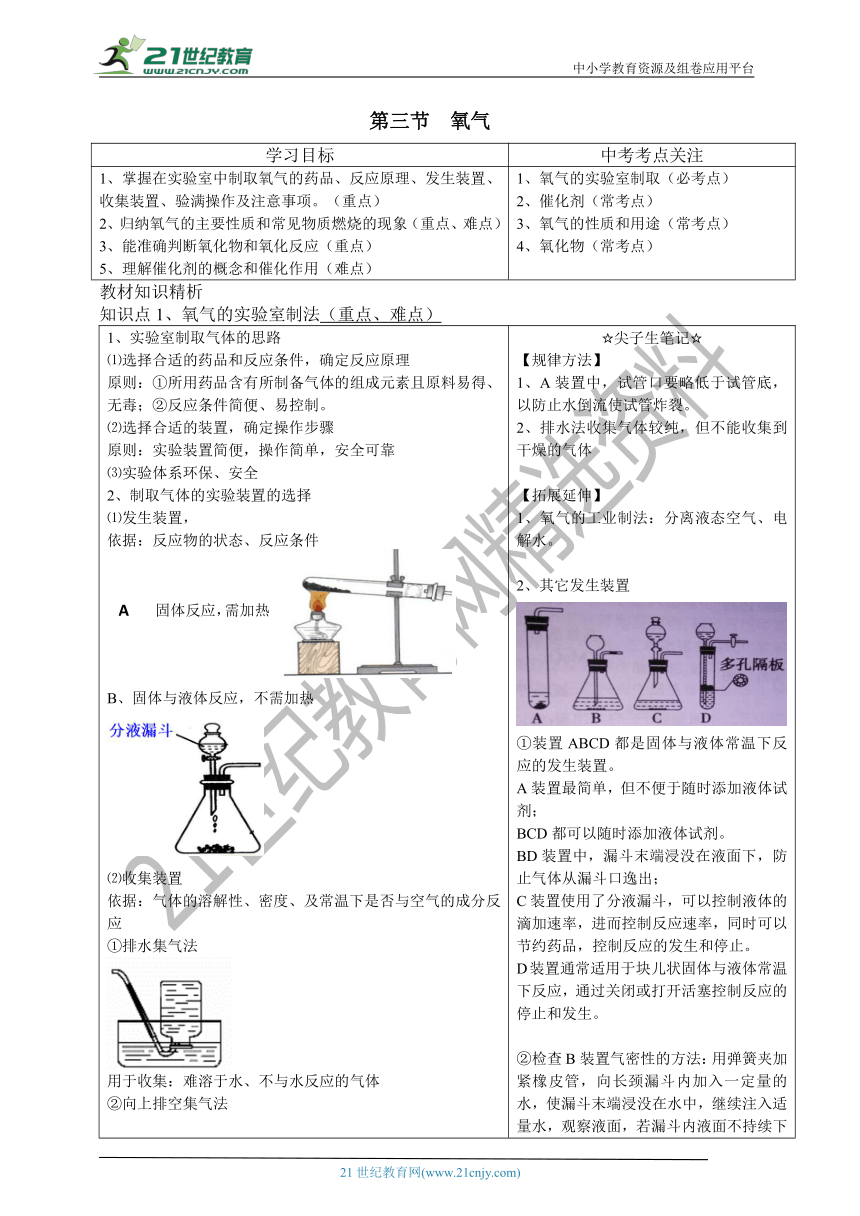
第三节 氧气 学习目标 中考考点关注 1、掌握在实验室中制取氧气的药品、反应原理、发生装置、收集装置、验满操作及注意事项。(重点) 2、归纳氧气的主要性质和常见物质燃烧的现象(重点、难点) 3、能准确判断氧化物和氧化反应(重点) 5、理解催化剂的概念和催化作用(难点) 1、氧气的实验室制取(必考点) 2、催化剂(常考点) 3、氧气的性质和用途(常考点) 4、氧化物(常考点) 教材知识精析 知识点1、氧气的实验室制法(重点、难点) 1、实验室制取气体的思路 ⑴选择合适的药品和反应条件,确定反应原理 原则:①所用药品含有所制备气体的组成元素且原料易得、无毒;②反应条件简便、易控制。 ⑵选择合适的装置,确定操作步骤 原则:实验装置简便,操作简单,安全可靠 ⑶实验体系环保、安全 2、制取气体的实验装置的选择 ⑴发生装置, 依据:反应物的状态、反应条件 B、固体与液体反应,不需加热 ⑵收集装置 依据:气体的溶解性、密度、及常温下是否与空气的成分反应 ①排水集气法 用于收集:难溶于水、不与水反应的气体 ②向上排空集气法 用于收集:密度比空气大、常温下不与空气中成分反应的气体 ③向下排空集气法 用于收集:密度比空气小、常温下不与空气中成分反应的气体 3、二氧化锰对过氧化氢分解的催化作用 ⑴实验探究 实验一: 现象:有少量气泡冒出, 木条不能复燃 结论:说明H2O2溶液在常温下放出氧气速率很慢 实验二: � 现象:有大量气泡冒出 ,木条复燃。 结论:说明在常温下H2O2溶液遇到二氧化锰(MnO2)时, 迅速产生氧气 实验三:反应停止后,将试管中的液体倒掉,重新向有剩余二氧化锰的试管中加入过氧化氢溶液,把带火星的木条伸入试管,观察发生的现象。 现象:木条复燃了 结 论:说明二氧化锰(MnO2)仍然起作用, 产生氧气,即反应前后二氧化锰的化学性质没有改变。 实验四:将反应后试管中剩余的物质过滤,干燥,称量,二氧化锰的质量与反应前一样 说明:反应前后二氧化锰的质量不变。 结论:二氧化锰是过氧化氢分解的催化剂 ⑵、催化剂和催化作用 ①概念:在化学反应中,能改变其他物质的化学反应的速率,而本身的质量和化学性质, 在反应前后都没有变化的物质叫催化剂(又叫触媒) ②特点:一变二不变 “一变”:改变其他物质的化学反应速率。 (注意:改变:可以是加快、也可以是减慢) “二不变”:本身的质量和化学性质都没有改变。 ③催化作用:催化剂在化学反应中所起的作用叫催化作用。 4、过氧化氢法制取氧气 ⑴药品:过氧化氢溶液、二氧化锰 ⑵原理: ⑶实验装置: ⑷操作步骤: ①组装仪器并检查装置的气密性 ②向锥形瓶内加入二氧化锰固体 ③塞好带有分液漏斗和导管的双孔塞 ④向分液漏斗内加入过氧化氢溶液 ⑤用排水法收集气体(导管口气泡均匀冒出时开始收集) ⑸检验:将一支带火星的木条伸进集气瓶内,若木条复燃,证明是氧气。 ⑹验满:将一支带火星的木条伸到集气瓶口,若木条复燃,证明已集满。 ⑺放置:将集满氧气的集气瓶正放在桌面上。 尖子生笔记 【规律方法】 1、A装置中,试管口要略低于试管底,以防止水倒流使试管炸裂。 2、排水法收集气体较纯,但不能收集到干燥的气体 【拓展延伸】 1、氧气的工业制法:分离液态空气、电解水。 2、其它发生装置 ①装置ABCD都是固体与液体常温下反应的发生装置。 A装置最简单,但不便于随时添加液体试剂; BCD都可以随时添加液体试剂。 BD装置中,漏斗末端浸没在液面下,防止气体从漏斗口逸出; C装置使用了分液漏斗,可以控制液体的滴加速率,进而控制反应速率,同时可以节约药品,控制反应的发生和停止。 D装置通常适用于块儿状固体与液体常温下反应,通过关闭或打开活塞控制反应的停止和发生。 ②检查B装置气密性的方法:用弹簧夹加紧橡皮管,向长颈 ... ...
~~ 您好,已阅读到文档的结尾了 ~~

