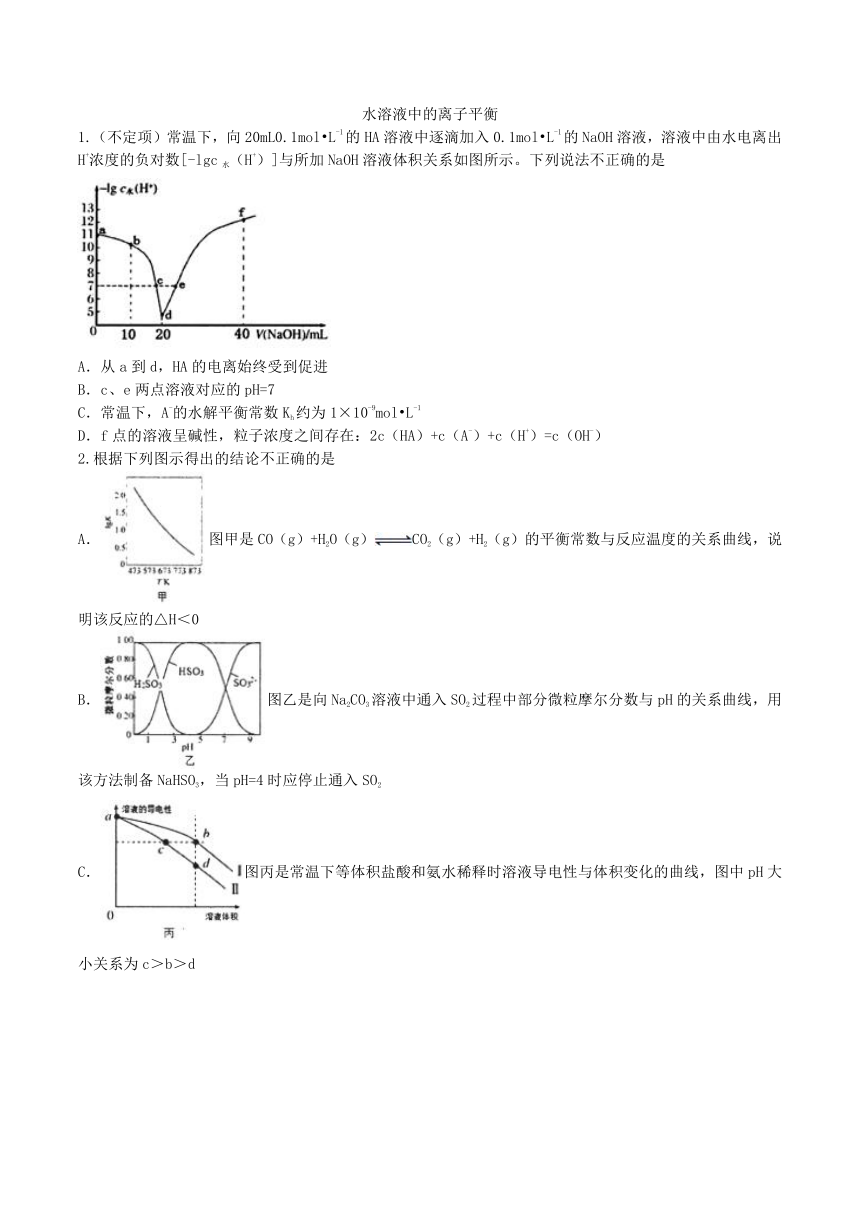
水溶液中的离子平衡 1.(不定项)常温下,向20mL0.1mol?L-1的HA溶液中逐滴加入0.1mol?L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是 A.从a到d,HA的电离始终受到促进 B.c、e两点溶液对应的pH=7 C.常温下,A-的水解平衡常数Kh约为1×10-9mol?L-1 D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-) 2.根据下列图示得出的结论不正确的是 A.图甲是CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的△H<0 B.图乙是向Na2CO3溶液中通入SO2过程中部分微粒摩尔分数与pH的关系曲线,用该方法制备NaHSO3,当pH=4时应停止通入SO2 C.图丙是常温下等体积盐酸和氨水稀释时溶液导电性与体积变化的曲线,图中pH大小关系为c>b>d D.图丁表示不同温度下水溶液中-lgc(H+)、-lgc(OH-)的变化曲线,图中T1>T2 3.常温下,H2SO3的电离常数:Ka1=1.54×10-2,Ka2=1×10-7。向mmL0.1mol/L H2SO3溶液中滴加0.1mol/LKOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示,下列说法正确的是 A.m=20 B.c点对应的溶液中存在c(K+)==c(HSO3-)+2c(SO32-) C.b、d两点溶液的pH=7 D.SO32-+H2O?HSO3-+OH-的Kh=1×10-7 4.化工生产中用(次磷酸钠)进行化学镀铜,反应的化学方程式为 CuSO4+2NaH2PO2+2NaOH=Cu+2NaH2PO3+Na2SO4+H2↑.下列说法正确的是 A.化学反应中,还原产物为Cu和H2 B.CuSO4溶液中离子浓度的大小顺序为c(SO42-)>c(Cu2+)>c(OH-)>c(H+) C.溶液中H2PO2-的电离方程式为H2PO2-?H++HPO22- D.NaH2PO3与过量NaOH反应生成Na2HPO3,判断H3PO3为二元酸 5.(不定项)已知:pNi= -lg c(Ni2+),常温下H2S的电离平衡常数:Kal=l. 3×10-7,Ka2=7. 1×10-15。常温下,向10 mL 0. 1 mol?L-1Ni(NO3)2溶液中滴加0.1 mol?L-1Na2S溶液,滴加过程中pNi与Na2S溶液体积的关系如图所示。下列说法正确的是 A.E、F、G三点中,F点对应溶液中水电离程度最大 B.常温下,Ksp(NiS) = 1×10-21 C.Na2S溶液中 c(S2- )+c(HS- )+c(H2S) =c(Na+) D.Na2S溶液中,S2-第一步水解常数Kh1= 6.(不定项)25℃时,向1L c(HA)+c(A-)=0.1mol/L的溶液中滴加盐酸或NaOH溶液,溶液中的H+、OH-、A-及HA的浓度的对数值(lgc)与pH的关系如图所示(不考虑溶液温度变化),下列说法正确的是 A.a表示lgc(A-)与pH的关系曲线 B.K(HA)的数量级为10-5 C.P点溶液中n(Na+)+ n(H+)=0.1mol D.滴加盐酸或NaOH溶液的过程中c(HA)·c(OH-)均增大 7.用0.100mol·L-1HC1溶液滴定0.100mol·L-1Na2CO3溶液的滴定曲线如图,已知。下列说法错误的是 A.a点溶液中:c(CO32-)>c(HCO3-) B.b点溶液中:c(Na+)>c(HCO3-)+c(CO32-)+c(H2CO3) C.c点溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) D.溶液中水的电离程度:a>b>c>d 8.已知溶解度也可用物质的量浓度表示,25℃时,Ag2CrO4在不同浓度CrO42-溶液中的溶解度如图所示,下列说法正确的是 A.图中a、b两点c(Ag+)相同 B.图中a点与b点Ag2CrO4溶度积相等 C.在a点向溶液中加入少量AgNO3,溶解度可变为c点 D.该温度下,Ag2CrO4溶度积的数量级为10-12 9.25℃时,分别向20.00mL 0.10mol·L-1的氨水、醋酸铵溶液中滴加0.10mol·L-1的氢碘酸,溶液pH与加入氢碘酸体积的变化关系如图所示。下列说法正确的是 A.A点与B点由水电离产生的氢氧根浓度A点大于B点 B.M点,c(NH3·H2O)>c(OH-)>c(H+)>c(NH4+) C.N点,c(I-)=c(NH3·H2O)+c(NH4+) D.P点,c(H+)+c(CH3COOH)=c(OH-)+c(I-)+c(NH3·H2O) 10.(不定项)25?℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)与溶液pH ... ...
~~ 您好,已阅读到文档的结尾了 ~~

