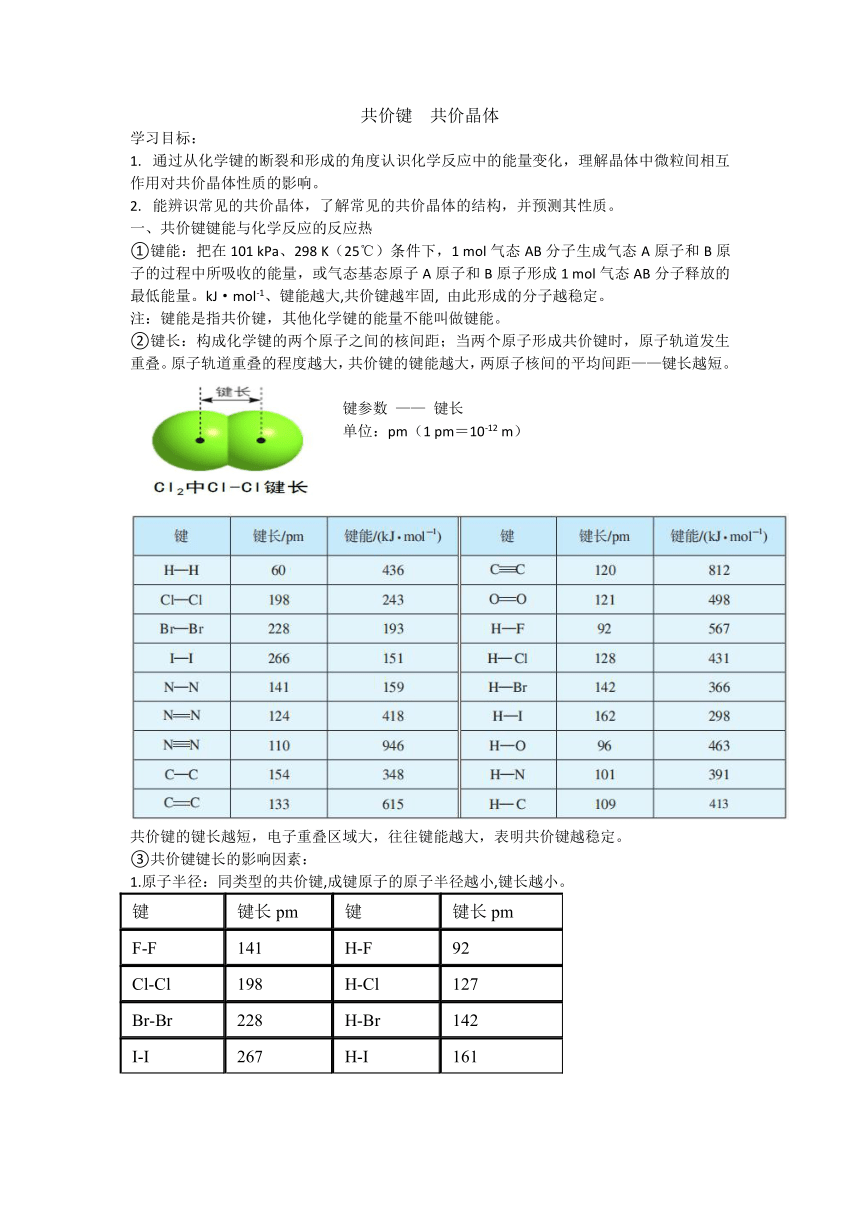
共价键 共价晶体 学习目标: 通过从化学键的断裂和形成的角度认识化学反应中的能量变化,理解晶体中微粒间相互作用对共价晶体性质的影响。 能辨识常见的共价晶体,了解常见的共价晶体的结构,并预测其性质。 共价键键能与化学反应的反应热 ①键能:把在101 kPa、298 K(25℃)条件下,1 mol气态AB分子生成气态A原子和B原子的过程中所吸收的能量,或气态基态原子A原子和B原子形成1 mol气态AB分子释放的最低能量。kJ·mol-1、键能越大,共价键越牢固, 由此形成的分子越稳定。 注:键能是指共价键,其他化学键的能量不能叫做键能。 ②键长:构成化学键的两个原子之间的核间距;当两个原子形成共价键时,原子轨道发生重叠。原子轨道重叠的程度越大,共价键的键能越大,两原子核间的平均间距———键长越短。 键参数 ——— 键长 单位:pm(1 pm=10-12 m) 共价键的键长越短,电子重叠区域大,往往键能越大,表明共价键越稳定。 ③共价键键长的影响因素: 1.原子半径:同类型的共价键,成键原子的原子半径越小,键长越小。 键 键长pm 键 键长pm F-F 141 H-F 92 Cl-Cl 198 H-Cl 127 Br-Br 228 H-Br 142 I-I 267 H-I 161 2.共用电子对数:相同的两个原子间形成共价键时, 单键键长>双键键长>三键键长。 键 键长pm C-C 154 C=C 133 C≡C 120 注:氟原子的半径很小,故F-F键的键长比Cl-Cl键短。但因两氟原子的原子核距离较小,斥力较大,故键能却比Cl-Cl小。 用键参数解释:HF、HCl、HBr、HI的稳定性 卤化氢 HCl HBr HI 在1 000 ℃分解的百分数/% 0.0014 0.5 33 氢卤键的键能(kJ·mol-1) 431.8 366 298.7 氢卤键的键长pm 127 142 161 注:结构相似的分子中,共价键的键能越大,分子越稳定。 ④N2(g)和O2(g)生成NO(g)过程中的能量变化 化学反应中发生旧化学键的断裂和新化学键的形成。 在化学反应中,旧化学键断裂吸收能量,新化学键的形成释放能量。反应焓变与键能的关系为: ΔH=反应物键能总和-生成物键能总和 ΔH<0时,为放热反应 ΔH>0时,为吸热反应 共价晶体:相邻原子间以共价键结合而形成空间网状结构的晶体。 组成的粒子:原子 粒子间的作用力:共价键 常见的共价晶体:常见的共价晶体 (1)硼(B)、硅(Si)、锗(Ge)和灰锡(Sn) (2)金刚砂(SiC)、氮化硅(Si3N4)和二氧化硅(SiO2) (3)极少数金属氧化物,如刚玉(Al2O3) 由于共价键的键能大,所以共价晶体一般具有很高的熔、沸点和很大的硬度。 金刚石晶体(与晶体硅) ①碳原子个数: 1+3+4=8 顶点:8× =1 面心:6× =3 体内:4 ②共价键数目:每个C参与了4条C—C键的形成,而在每条键中的贡献只有一半,故C原子与C—C键数之比为:1 :(4 x )= 1:2 碳化硅:将晶体硅晶胞的顶点、面心上的硅原子换成碳原子,体内4个硅原子不变,就是碳化硅的晶胞 注:每个碳化硅晶胞中有4个碳原子、4个硅原子。 二氧化硅晶体: SiO2晶体中最小环上有12个原子,1 mol SiO2中含有4 mol Si—O键 因此二氧化硅晶体中并不存在单个的SiO2分子,它是由硅原子和氧原子按1∶2的比例组成的空间立体网状结构的晶体。 注:对于结构相似的共价晶体而言, 共价键的键长越长,键能就越小,晶体的熔、沸点越低,硬度越小。 共价晶体的物理性质 ①熔点很高 共价晶体中,原子间以较强的共价键相结合,要使物质熔化就要克服共价键,需要很高的能量。 ②硬度很大:共价键作用强。 ③一般不导电,但晶体硅是半导体 ④难溶于一般溶剂 ... ...
~~ 您好,已阅读到文档的结尾了 ~~