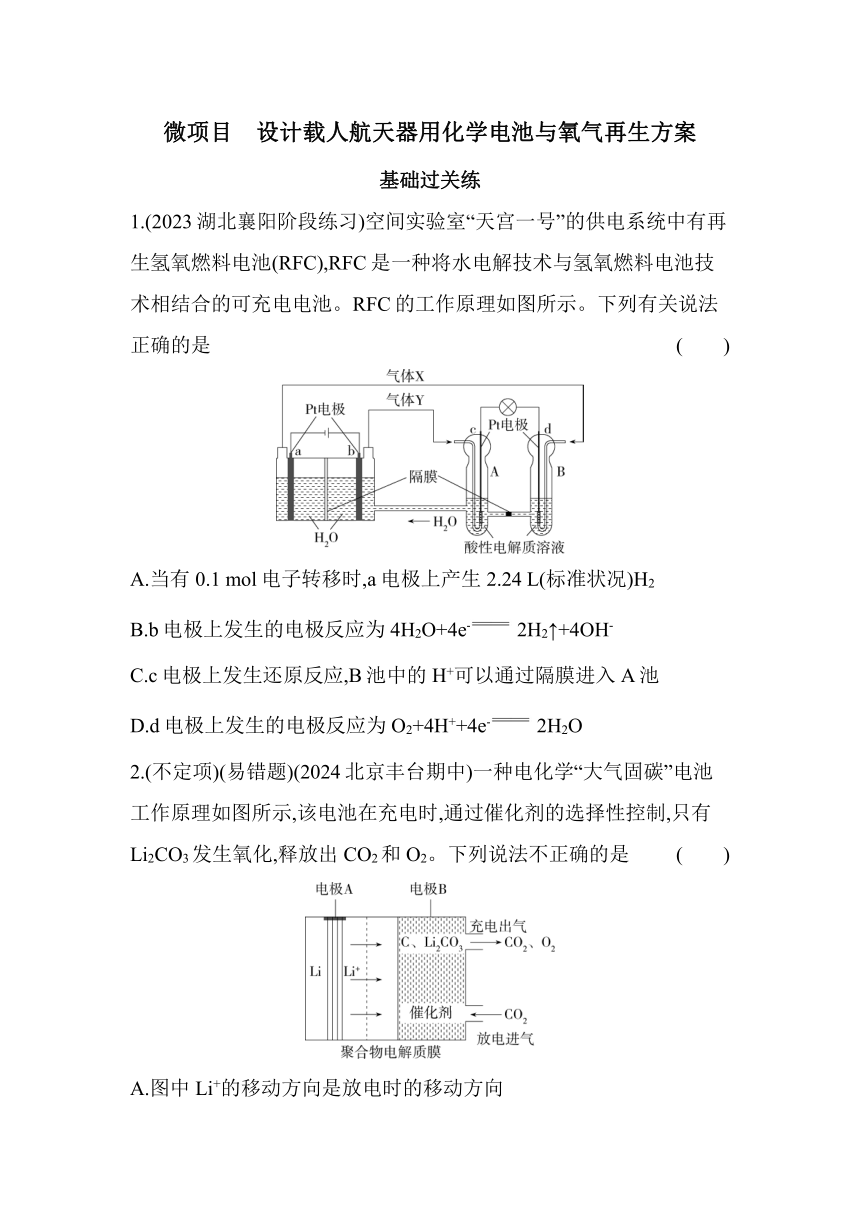
微项目 设计载人航天器用化学电池与氧气再生方案 基础过关练 1.(2023湖北襄阳阶段练习)空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC的工作原理如图所示。下列有关说法正确的是 ( ) A.当有0.1 mol电子转移时,a电极上产生2.24 L(标准状况)H2 B.b电极上发生的电极反应为4H2O+4e- 2H2↑+4OH- C.c电极上发生还原反应,B池中的H+可以通过隔膜进入A池 D.d电极上发生的电极反应为O2+4H++4e- 2H2O 2.(不定项)(易错题)(2024北京丰台期中)一种电化学“大气固碳”电池工作原理如图所示,该电池在充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2。下列说法不正确的是 ( ) A.图中Li+的移动方向是放电时的移动方向 B.充电时阳极发生的反应为C+2Li2CO3-4e- 3CO2↑+4Li+ C.该电池可选用含Li+的水溶液作电解质溶液 D.该电池每循环充、放电一次各转移4 mol电子时,理论上可固定标准状况下22.4 L CO2 3.载人航天器中利用萨巴蒂尔反应再生O2的流程如图所示。 (1)萨巴帝尔反应是放热反应,控制反应器内的温度非常重要,反应温度过低则会造成 。已知此反应在300~400 ℃时转化率较高,所以一般会将进入反应器的气体预热到此温度,同时反应器配有 装置,以便及时将过多的反应热传走。 (2)这种方法再生O2的最大缺点是需要不断补充 (填化学式)。 (3)载人航天器中CO2的富集与转化是O2再生的核心问题,如图是电化学富集CO2的方法。 ①离子导体中,K+向多孔碳载镍 (填“A”或“B”)电极移动。 ②负极的电极反应式是 。 ③在多孔碳载镍A电极上消耗1 mol H2,理论上多孔碳载镍B电极转化的CO2在标准状况下的体积是 L。 答案与分层梯度式解析 基础过关练 1.C 电解池中,b电极为阳极,发生氧化反应:4OH--4e- 2H2O+O2↑,a电极为阴极,发生还原反应:4H++4e- 2H2↑;原电池中电解质溶液呈酸性,d电极为负极,发生氧化反应:2H2-4e- 4H+,c电极为正极,发生还原反应:O2+4H++4e- 2H2O。当有0.1 mol电子转移时,a电极产生1.12 L(标准状况)H2,故A错误;b电极上发生的电极反应是4OH--4e- 2H2O+O2↑,故B错误;c电极为正极,发生还原反应,B池中的H+可以通过隔膜进入A池,故C正确;d电极上发生的电极反应为H2-2e- 2H+,故D错误。 2.BC 根据装置图可知,放电时,电极A为原电池的负极,电极B为正极,则图中Li+的移动方向是放电时的移动方向,A正确;充电时,通过催化剂的选择性控制,只有Li2CO3发生氧化,释放出CO2和O2,阳极(电极B)电极反应式为2Li2CO3-4e- 4Li++2CO2↑+O2↑,放电时,正极(电极B)的电极反应式为3CO2+4e-+4Li+ 2Li2CO3+C,则该电池每循环充、放电一次各转移4 mol电子时,理论上可固定1 mol CO2,标准状况下体积为22.4 L,B错误、D正确;金属锂与水反应,该电池不可选用含锂离子的水溶液作电解质溶液,C错误。 易错分析 (1)由于2Li+2H2O 2LiOH+H2↑,所以锂电池不能用含锂离子的水溶液作电解质溶液。 (2)本题已知信息中指出,该电池在充电时,通过催化剂的选择性控制,电池放电时的正极反应式与充电时的阳极电极反应式不能简单地颠倒来写。 3.答案 (1)反应速率下降 冷却 (2)H2 (3)①B ②H2-2e-+C H2O+CO2 ③5.6 解析 (1)若反应温度过低,会造成反应速率下降;萨巴帝尔反应是放热反应,且此反应在300~400 ℃时转化率较高,则反应器应该配有冷却装置。(2)根据转化关系图示知萨巴帝尔反应为CO2+4H2 CH4+2H2O,而2H2O 2H2↑+O2↑,说明用这种方法再生O2的最大缺点是需要不断补充H2。(3)①由题图可知,H2在多孔碳载镍A上失电子,CO2在多孔碳载镍B上得电子生成CH4,故多孔碳载镍A电极为负极,多孔碳载镍B电极为正极,原电池工作时阳 ... ...
~~ 您好,已阅读到文档的结尾了 ~~