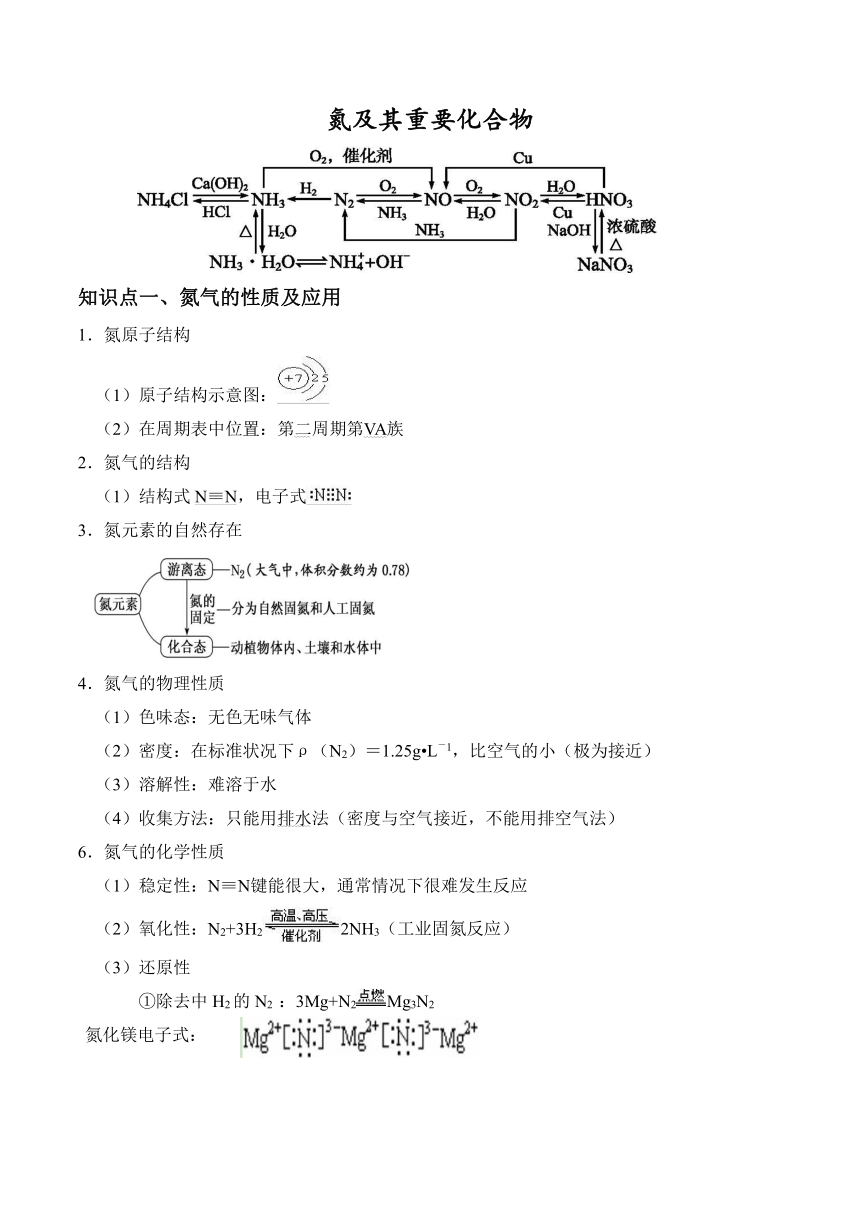
氮及其重要化合物 知识点一、氮气的性质及应用 1.氮原子结构 (1)原子结构示意图: (2)在周期表中位置:第二周期第VA族 2.氮气的结构 (1)结构式N≡N,电子式 3.氮元素的自然存在 4.氮气的物理性质 (1)色味态:无色无味气体 (2)密度:在标准状况下ρ(N2)=1.25g L-1,比空气的小(极为接近) (3)溶解性:难溶于水 (4)收集方法:只能用排水法(密度与空气接近,不能用排空气法) 6.氮气的化学性质 (1)稳定性:N≡N键能很大,通常情况下很难发生反应 (2)氧化性:N2+3H22NH3(工业固氮反应) (3)还原性 ①除去中H2的N2 :3Mg+N2Mg3N2 氮化镁电子式: ②高能固氮反应:N2+O22NO 7.氮的固定(氮元素由游离态变为化合态) 合成氨适宜条件的选择 催化剂:虽不能改变化学平衡,但可以加快反应速率,提高单位时间内的产量。 温度:升高温度可加快反应速率,但从平衡移动考虑,此反应温度不宜太高。使催化剂的活性最大也是选择温度的另一个重要因素。 压强:增大压强既可以加快反应速率又可以使化学平衡向正反应方向移动。但生产设备能不能承受那么大的压强,产生压强所需的动力、能源 又是限制压强的因素。 浓度:在生产过程中,不断补充N2和H2,及时分离出NH3,不但可以加快反应速率,还能使平衡右移,提高NH3的产量。 合成氨的适宜条件 压强:20~50MPa 温度:500℃左右(此时催化剂的活性最大) 催化器:铁触媒(以铁为主体的多成分催化剂) 自然界中氮的循环 8.氮气的用途 (1)工业上合成氨,制硝酸 (2)代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化 (3)在灯泡中填充氮气以防止钨丝被氧化或挥发 (4)保存粮食、水果等食品,以防止腐烂 (5)医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术 (6)高科技利用液氮制造低温环境,使某些超导材料获得超导性能 知识点二、氮的氧化物 1.氮元素的六种氧化物 化合价 +1 +2 +3 +4 +5 化学式 N2O NO N2O3 NO2 N2O4 N2O5 含氧酸 HNO2 HNO3 2.NO的性质 (1)色味态:无色无味气体 (2)溶解性:难溶于水 (3)强还原性 ①与O2反应:2NO+O22NO2 ②与酸性H2O2反应:2NO+3H2O22H++2NO3-+2H2O ③酸性KMnO4溶液:5NO+3MnO4-+4H+5NO3-+3Mn2++2H2O ④除去NO2中的NO:NO+2HNO3(浓)3NO2↑+H2O 3.NO2的性质 (1)色味态:红棕色有刺激性气味气体 (2)溶解性:易溶于水,不溶于四氯化碳 (3)与H2O反应:3NO2+H2O2HNO3+NO (4)双聚反应:2NO2N2O4;△H<0 ①加热:红棕色变深 ②加压:颜色先变深后变浅,比加压前深 (5)强氧化性:能够将某些还原性微粒氧化,自身被还原成NO 还原性微粒 氧化产物 S SO3或SO42- I2 Fe3+ ①2NO2+2KI=2KNO2+I2(湿润的淀粉碘化钾试纸变蓝,可用于检验NO2) ②NO2+SO2SO3+NO ③H2S+NO2S+NO+H2O ④2Fe2++4H++NO22Fe3++2H2O+NO↑ (6)鉴别NO2和溴蒸气 方法 现象 二氧化氮 溴蒸汽 水溶解法 气体由红棕色变成无色,得到无色溶液 溶液变为橙色 AgNO3沉淀法 气体由红棕色变成无色,溶液无明显变化 产生浅黄色沉淀 CCl4溶解法 无明显现象 得到橙红色溶液 密闭加热法 颜色明显加深 无明显现象 密闭冷却法 颜色明显变浅 得到深红棕色液体 湿润的淀粉 碘化钾试纸法 变蓝 变蓝 4.氮氧化物的危害 (1)形成硝酸型酸雨 含氮物质NONO2HNO3 (2)形成光化学烟雾 NO2和O2O3有毒烟雾 (3)破坏臭氧层:NO催化O3分解为O2 NO+O3=NO2+O,NO2+O=NO+O2 (4)水体富营养化:水中含氮化合物引起水体污染 5.常见的处理氮氧化物的方法 (1)NaOH溶液吸收法 ①2NO2+2NaOHNaNO2+NaNO3+H2O ②NO+NO2+2NaOH2NaNO2+H2O (2)纯碱溶液吸收法 ①2NO2+Na2CO3NaNO3+NaNO2+CO2↑ ②NO2+NO+Na2CO32NaNO2+CO2↑ (3)CH4还原法 ①2CH4+2NO2N2+2CO2+4H2O ... ...
~~ 您好,已阅读到文档的结尾了 ~~