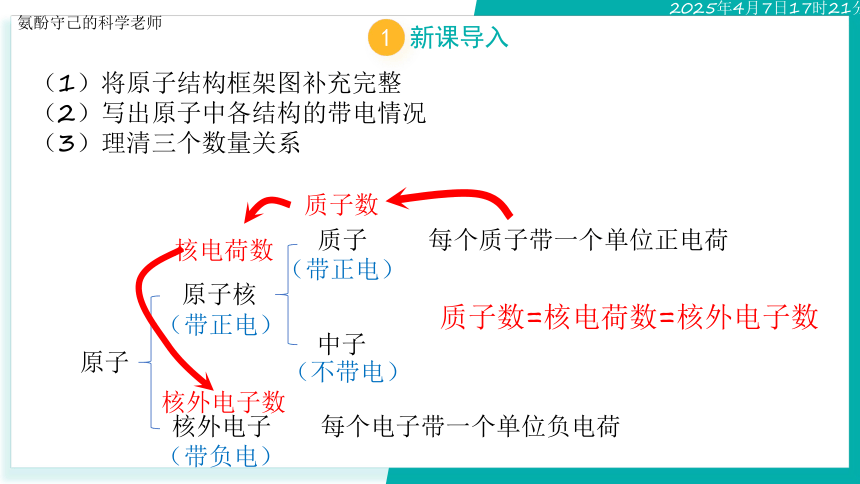
(
课件网) 1 新课导入 原子 原子核 核外电子 质子 中子 每个质子带一个单位正电荷 每个电子带一个单位负电荷 质子数 核电荷数 (带正电) (带正电) (带负电) (1)将原子结构框架图补充完整 (2)写出原子中各结构的带电情况 (3)理清三个数量关系 (不带电) 核外电子数 质子数=核电荷数=核外电子数 2.3.2 原子结构的模型 【核心概念】 1.物质的结构与性质 【学习内容与要求】 1.6 物质由微观粒子构成 知道原子由原子核和核外电子构成,原子可以结合成分子,同一元素的原子和离子可以相互转化。 了解核外电子对化学反应的作用。 1.科学观念:知道离子的形成,物质也可由离子构成;知道元素由核电荷数决定;了解同位素的结构特点。 2.科学思维:通过离子形成的模型分析,理解离子的形成。 3.探究实践:通过构建原子模型,体验同位素原子的结构。 4.态度责任:通过认识微观世界粒子的运动的学习活动,培养学生科学求真的态度。 2 核心概念与素养 3 新知探究 1.1 氯化钠的形成 任务一:知道离子的形成,物质也可由离子构成 通过化学变化制取食盐 实验现象: 剧烈燃烧,放出热量,发出黄色火焰,产生大量白烟,生成白色固体。 化学反应文字表达式: 钠 + 氯气 氯化钠 点燃 黄绿色 请从微观角度解释氯气和氧气在点燃条件下生成氯化钠的过程 建模 失去1个电子 钠离子 得到1个电子 质子数=电子数 质子数>电子数 带正电 阳离子 钠原子 氯原子 氯离子 质子数<电子数 带负电 阴离子 原子得失电子形成离子。 失去电子 得到电子 氯离子 钠离子 阴、阳离子相互吸引,构成了电中性的氯化钠。 氯化钠由钠离子和氯离子构成。 离子也是构成物质的一种微粒。 1.2 离子的形成 原子得失电子形成离子。 原子 失去电子 阳离子 带正电的原子 得到电子 阴离子 带负电的原子 离子是带电的原子! 14.下表是某位同学收集的一些单核粒子的资料,请根据表格数据回答下列问题。 (1)上述粒子中属于原子的是_____(填字母,下同)。 (2)表格中互为同位素的粒子是_____。 (3)比较C与D两种粒子,其中质量较大的是_____。 粒子 质子数 中子数 电子数 带电性 A 14 14 14 不带电 B 26 30 24 带2个单位正电荷 C 14 14 18 带4个单位负电荷 D 14 16 14 不带电 A、D A、D D 带正电 不带电 带负电 15.请从“构成物质的粒子”的角度对下列物质进行分类:氢气、水、硫酸铜、汞、氯化钠、铝。 (1)由原子构成的物质:_____。 (2)由分子构成的物质:_____。 (3)由离子构成的物质:_____。 汞、铝 氢气、水 硫酸铜、氯化钠 总结规律: (1)由原子构成的物质:金属、金刚石、石墨、钻石 (2)由分子构成的物质:氢气、氧气、水、酒精 (3)由离子构成的物质:金属化合物 任务二:知道元素由核电荷数决定 所有核电荷数为17的原子的总称为氯元素。 原子种类 核电荷数 质子数 中子数 核外电子数 钠原子 11 11 12 11 钠离子 11 11 12 10 氯原子 17 17 18 17 氯原子 17 17 20 17 氯离子 17 17 20 18 所有核电荷数为11的原子的总称为钠元素。 把具有相同核电荷数(即质子数)的同一类原子总称为元素。 元素的种类由核电荷数(即质子数)决定。 (1)分析下列粒子中的微粒数量 ,说说有什么规律 (2)请你为“元素”这个概念下一个定义 2.1 元素定义 如下图是氧的3 种原子的原子核,有什么相同点? 具有相同的核电荷数(即质子数)。 核电荷数(即质子数)为8。 同种元素,为氧元素。 氧元素就是所有氧原子的总称。 元素只有种类,没有个数! 氧的 3 种同位素原子的质量大小相等吗? 原子的质量主要集中在原子核上。 原子的质量等于质子和中子的质量总和。 质子数+中子数=相对原子质量 相对原子质量=16 相对原子质量=17 相 ... ...