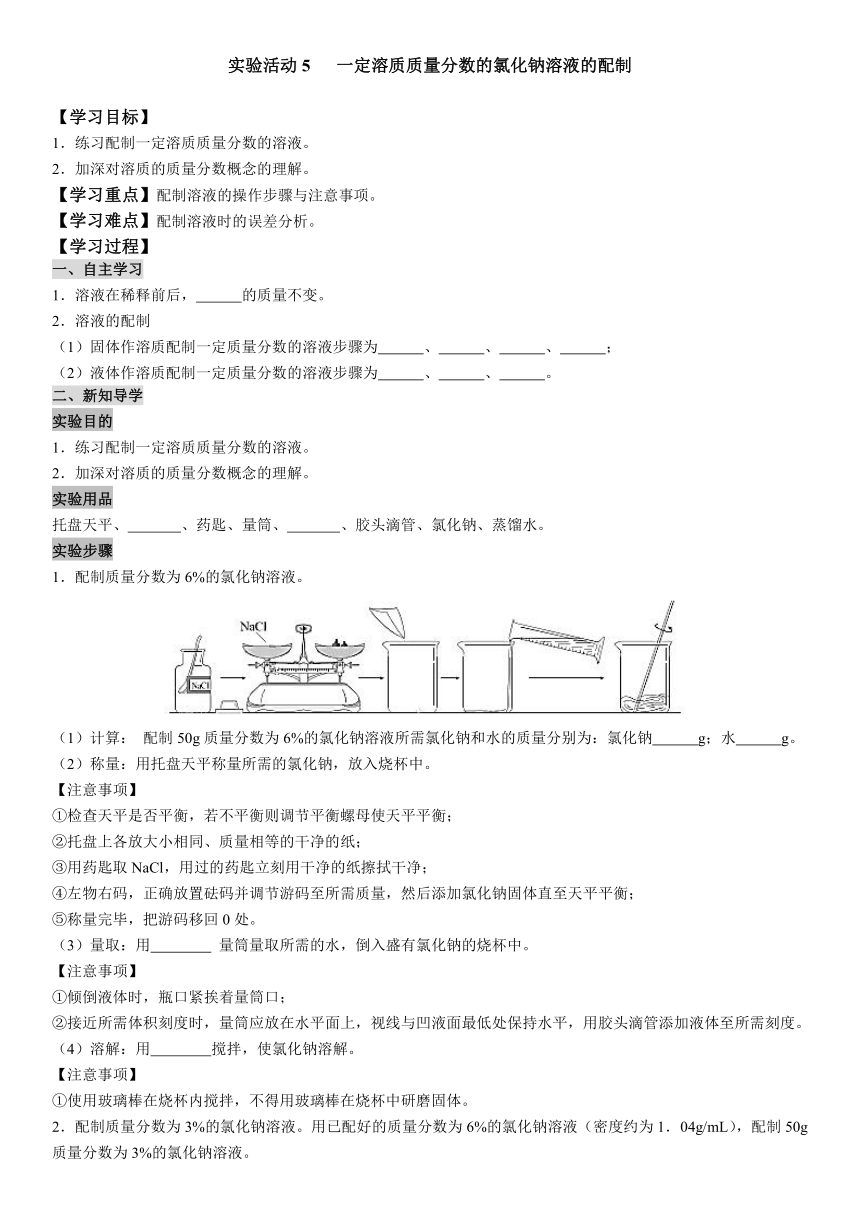
实验活动5 一定溶质质量分数的氯化钠溶液的配制 【学习目标】 1.练习配制一定溶质质量分数的溶液。 2.加深对溶质的质量分数概念的理解。 【学习重点】配制溶液的操作步骤与注意事项。 【学习难点】配制溶液时的误差分析。 【学习过程】 一、自主学习 1.溶液在稀释前后, 的质量不变。 2.溶液的配制 (1)固体作溶质配制一定质量分数的溶液步骤为 、 、 、 ; (2)液体作溶质配制一定质量分数的溶液步骤为 、 、 。 二、新知导学 实验目的 1.练习配制一定溶质质量分数的溶液。 2.加深对溶质的质量分数概念的理解。 实验用品 托盘天平、 、药匙、量筒、 、胶头滴管、氯化钠、蒸馏水。 实验步骤 1.配制质量分数为6%的氯化钠溶液。 (1)计算: 配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 g;水 g。 (2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。 【注意事项】 ①检查天平是否平衡,若不平衡则调节平衡螺母使天平平衡; ②托盘上各放大小相同、质量相等的干净的纸; ③用药匙取NaCl,用过的药匙立刻用干净的纸擦拭干净; ④左物右码,正确放置砝码并调节游码至所需质量,然后添加氯化钠固体直至天平平衡; ⑤称量完毕,把游码移回0处。 (3)量取:用 量筒量取所需的水,倒入盛有氯化钠的烧杯中。 【注意事项】 ①倾倒液体时,瓶口紧挨着量筒口; ②接近所需体积刻度时,量筒应放在水平面上,视线与凹液面最低处保持水平,用胶头滴管添加液体至所需刻度。 (4)溶解:用 搅拌,使氯化钠溶解。 【注意事项】 ①使用玻璃棒在烧杯内搅拌,不得用玻璃棒在烧杯中研磨固体。 2.配制质量分数为3%的氯化钠溶液。用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/mL),配制50g质量分数为3%的氯化钠溶液。 (1)计算:配制50g质量分数为3%的氧化钠溶液所需质量分数为6%的氯化钠溶液和水的质量分别为:氯化钠溶液 g(体积 mL);水 g; (2)量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。 (3)混匀:用玻璃棒搅拌,使溶液混合均匀。 3.把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。 4.实验结束后,清理桌面,所用的药品和仪器放回原位。 三、实验小结 1.配制的溶液的溶质质量分数偏大的原因: (1)量取水时俯视读数,导致水量偏 ; (2)量筒内的水倒入烧杯时有少量洒在烧杯外; (3)砝码生锈,导致称量的药品质量偏 ; 2.配制的溶液的溶质质量分数偏小的原因: (1)量取水时仰视读数,导致水量偏 ; (2)称量时“左码右物”(使用了游码),导致称量的药品质量偏 ; (3)使用的药品不纯。 四、当堂检测 1.实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( ) A.烧杯 B.量筒 C.集气瓶 D.托盘天平 2.小明要配制50g质量分数为14%的氢氧化钠溶液来制作“叶脉书签”。下列关于配制该溶液的说法不正确的是( ) ①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0g ②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸 ③选用200mL量筒量取所需水的体积 ④实验中用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管和试剂瓶 ⑤用量筒量取水时,俯视读数,配得溶液的溶质质量分数偏小 A.①③ B.②③⑤ C.③⑤ D.②④⑤ 3.实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是( ) A.用50 mL量筒量水 B.将固体放于托盘天平的右盘称取 C.将固体直接投入量筒中溶解 D.将配好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞 4.质量分数为10%的盐酸5 g,加水稀释至250 g后取出10 g,则此10 g溶液中溶质的质量分数是( ) A.0.2% ... ...
~~ 您好,已阅读到文档的结尾了 ~~