(
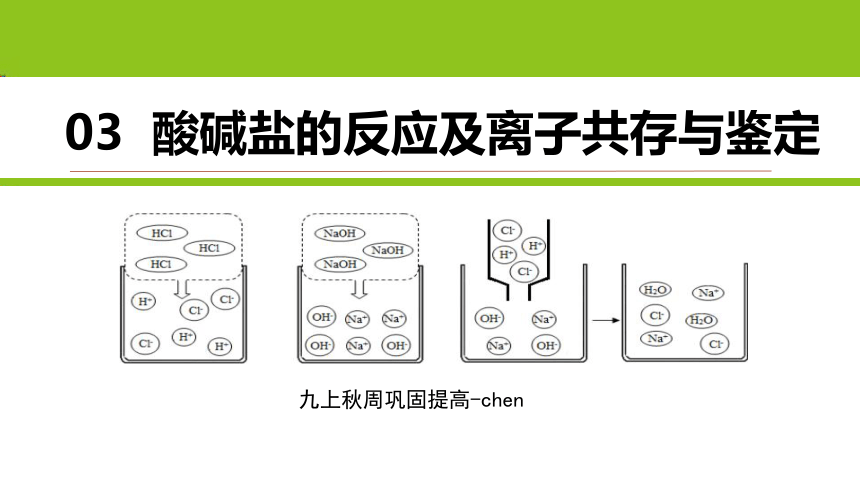
课件网) 03 酸碱盐的反应及离子共存与鉴定 九上秋周巩固提高-chen 一、酸碱盐的反应 1.复分解反应 1)可溶性表 一、酸碱盐的反应 1.复分解反应 2)反应类型 通式:AB + CD = AD + CB 特点:反应前后化合价均不变 反应物类别 反应物条件 生成物条件 盐+盐 二者都可溶 至少具备下列三个条件中的一个: ①有沉淀生成 ②有气体生成 ③有水生成 盐+碱 二者都可溶 盐+酸 盐可溶或难溶,酸可溶 酸+碱 至少一种可溶 酸+金属氧化物 酸可溶 一、酸碱盐的反应 1.复分解反应 3)反应本质 AB + CD = AD + CB 复分解反应的本质就是: 溶液中离子的结合 在溶液中电离的离子遇到能和它结合成难溶于水的、难电离的、不稳定的等物质时,脱离溶液的过程 思考一个问题:某溶液中有钾离子,钠离子,氯离子,硝酸根四种离子时,不断蒸发水分,能结晶出什么物质? 一、酸碱盐的反应 1.复分解反应 4)反应先后顺序 有竞争关系 无竞争关系 HCl加入(NaOH、 Na2CO3) H2SO4加入(NaOH同时BaCl2) Na2CO3加入(HCl、 CaCl2 ) NaOH加入(HCl、 MgCl2) HCl加入(NaOH、 AgNO3) 一种反应的生成物与另一个反应物反应,宏观表现为后反应 生成物不会继续反应 宏观表现为同时反应 二、离子共存 1.离子共存 离子共存:实质上就是看离子间是否会发生反应的问题。若在溶液中会发生反应,就不能共存。 溶液中离子不能共存的情况: (1)生成沉淀:如 Ag+和 Clˉ ,Ba2+和 SO42ˉ ,CO32-和 Ca2+ Cu2+和 OH-等不能大量共存。 (2)生成气体:如H+和 CO32- ,HCO3-,NH4+和 OH- (3)生成水:如 H+和 OH-不能大量共存 。 (4)可能会有附加条件: 如pH=1(酸性溶液)、pH=14(碱性溶液)、溶液颜色等 有色离子:Fe3+ (棕黄), Fe2+(浅绿)、Cu2+(蓝)、 MnO4-(紫色)等 三、离子检验与鉴定 1.离子检验与鉴定 通过离子反应表现出来的不同现象来检验离子 离子鉴定往往要考虑的干扰因素比检验要多 1)氯离子检验 Cl- 试剂:AgNO3溶液和稀HNO3 方法:取样,将AgNO3溶液滴入待测液中,再加稀HNO3 现象:生成不溶于稀HNO3的白色沉淀 化学方程式:NaCl + AgNO3 =AgCl ↓+ NaNO3 加稀HNO3的目的:硝酸酸化,排除碳酸根离子,氢氧根等离子 的干扰。 三、离子检验与鉴定 2)硫酸根离子检验 SO42- 试剂:Ba(NO3)2溶液和稀HNO3 方法:取待测液少许,将Ba(NO3)2溶液滴入待测液中, 再加稀HNO3 现象:生成白色沉淀 化学方程式:Ba(NO3)2+Na2SO4=BaSO4↓+2NaCl 加HNO3的目的:酸化,排除碳酸根离子的干扰。 三、离子检验与鉴定 3)碳酸根离子检验 CO32- ①气体法: 试剂:稀盐酸和澄清石灰水 方法:取待测液少许,加入足量稀盐酸,若有气体产生,将产生的气体通入澄清石灰水中。 现象:澄清石灰水变浑浊。 化学方程式:CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ ②沉淀法(只适合鉴别): 试剂:含Ba2+或含Ca2+的溶液 方法:取待测液少许,加入Ca(NO3)2。 现象:有白色沉淀生成 化学方程式:Na2CO3 + Ca(NO3)2 = CaCO3↓ + 2NaNO3 三、离子检验与鉴定 4)铵根离子检验 NH4+ 试剂:NaOH溶液和湿润的红色石蕊试纸或无色酚酞溶液 方法:取待测液少许于试管中,加入NaOH溶液加热,将湿润的红色石蕊试纸置于试管口。或将产生的气体通入无色酚酞溶液 现象:湿润的红色石蕊试纸变蓝。无色酚酞变红 化学方程式:NaOH + NH4Cl = NaCl + NH3↑ + H2O 三、离子检验与鉴定 5)多个离子检验的顺序 先检验的离子不能被后面的离子干扰 前面的离子检验后,也不能影响后面的离子检验 例:( SO42-,Cl-,CO32-,OH-) 先加硝酸钡,检验SO42-与CO32- 再加硝酸镁,检验OH- 最后加硝酸银 检验Cl- 三、离子检验与鉴定 6)常见的固体颜色 1.红色固体:铜,氧化铁; 2. ... ...